| Металл или сплав | tпл. С |
|---|---|
| Алюминий | 660,4 |
| Вольфрам | 3420 |
| Германий | 937 |
| Дуралюмин | ~650 |
| Железо | 1539 |
| Золото | 1064?4 |
| Инвар | 1425 |
| Иридий | 2447 |
| Калий | 63,6 |
| Карбиды гафния | 3890 |
| ниобия | 3760 |
| титана | 3150 |
| циркония | 3530 |
| Константин | ~1260 |
| Кремний | 1415 |
| Латунь | ~1000 |
| Легкоплавкий сплав | 60,5 |
| Магний | 650 |
| Медь | 1084,5 |
| Натрий | 97,8 |
| Нейзильбер | ~1100 |
| Никель | 1455 |
| Нихром | ~1400 |
| Олово | 231,9 |
| Осмий | 3030 |
| Платина | 17772 |
| Ртуть | - 38,9 |
| Свинец | 327,4 |
| Серебро | 961,9 |
| Сталь | 1300-1500 |
| Фехраль | ~1460 |
| Цезий | 28,4 |
| Цинк | 419,5 |
| Чугун | 1100-1300 |
Вернуться в раздел аналитики
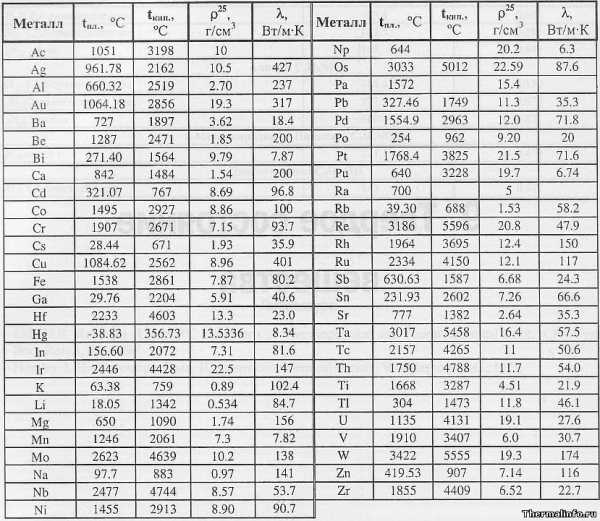
Запись опубликована автором admin в рубрике Полезные материалы. Добавьте в закладки постоянную ссылку.В таблице представлена температура плавления металлов tпл, их температура кипения tк при атмосферном давлении, плотность металлов ρ при 25°С и теплопроводность λ при 27°С.
Температура плавления металлов, а также их плотность и теплопроводность приведены в таблице для следующих металлов: актиний Ac, серебро Ag, алюминий Al, золото Au, барий Ba, берилий Be, висмут Bi, кальций Ca, кадмий Cd, кобальт Co, хром Cr, цезий Cs, медь Cu, железо Fe, галлий Ga, гафний Hf, ртуть Hg, индий In, иридий Ir, калий K, литий Li, магний Mg, марганец Mn, молибден Mo, натрий Na, ниобий Nb, никель Ni, нептуний Np, осмий Os, протактиний Pa, свинец Pb, палладий Pd, полоний Po, платина Pt, плутоний Pu, радий Ra, рубидий Pb, рений Re, родий Rh, рутений Ru, сурьма Sb, олово Sn, стронций Sr, тантал Ta, технеций Tc, торий Th, титан Ti, таллий Tl, уран U, ванадий V, вольфрам W, цинк Zn, цирконий Zr.
По данным таблицы видно, что температура плавления металлов изменяется в широком диапазоне (от -38,83°С у ртути до 3422°С у вольфрама). Низкой положительной температурой плавления обладают такие металлы, как литий (18,05°С), цезий (28,44°С), рубидий (39,3°С) и другие щелочные металлы.
Наиболее тугоплавкими являются следующие металлы: гафний, иридий, молибден, ниобий, осмий, рений, рутений, тантал, технеций, вольфрам. Температура плавления этих металлов выше 2000°С.
Приведем примеры температуры плавления металлов, широко применяемых в промышленности и в быту:
Максимальной температурой кипения из металлов, представленных в таблице, обладает рений Re — она составляет 5596°С. Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Плотность металлов в таблице находится в диапазоне от 0,534 до 22,59 г/см3, то есть самым легким металлом является литий, а самым тяжелым металлом осмий. Следует отметить, что осмий имеет плотность большую, чем плотность урана и даже плутония при комнатной температуре.
Теплопроводность металлов в таблице изменяется от 6,3 до 427 Вт/(м·град), таким образом хуже всего проводит тепло такой металл, как нептуний, а лучшим теплопроводящим металлом является серебро.
Представлена таблица значений температуры плавления стали распространенных марок. Рассмотрены стали для отливок, конструкционные, жаропрочные, углеродистые и другие классы сталей.
Температура плавления стали находится в диапазоне от 1350 до 1535°С. Стали в таблице расположены в порядке возрастания их температуры плавления.
| Сталь | tпл, °С | Сталь | tпл, °С |
|---|---|---|---|
| Стали для отливок Х28Л и Х34Л | 1350 | Коррозионно-стойкая жаропрочная 12Х18Н9Т | 1425 |
| Сталь конструкционная 12Х18Н10Т | 1400 | Жаропрочная высоколегированная 20Х23Н13 | 1440 |
| Жаропрочная высоколегированная 20Х20Н14С2 | 1400 | Жаропрочная высоколегированная 40Х10С2М | 1480 |
| Жаропрочная высоколегированная 20Х25Н20С2 | 1400 | Сталь коррозионно-стойкая Х25С3Н (ЭИ261) | 1480 |
| Сталь конструкционная 12Х18Н10 | 1410 | Жаропрочная высоколегированная 40Х9С2 (ЭСХ8) | 1480 |
| Коррозионно-стойкая жаропрочная 12Х18Н9 | 1410 | Коррозионно-стойкие обыкновенные 95Х18…15Х28 | 1500 |
| Сталь жаропрочная Х20Н35 | 1410 | Коррозионно-стойкая жаропрочная 15Х25Т (ЭИ439) | 1500 |
| Жаропрочная высоколегированная 20Х23Н18 (ЭИ417) | 1415 | Углеродистые стали | 1535 |
Источники:
| Алюминий (Al) / Aluminum | 660 | 1220 |
| Алюминиевые сплавы / Aluminum Alloy | 463 - 671 | 865 - 1240 |
| Баббит = Babbitt | 249 | 480 |
| Бериллий (Be) = Beryllium | 1285 | 2345 |
| Бронза алюминиевая = Aluminum Bronze | 1027 - 1038 | 1881 - 1900 |
| Бронза бериллиевая, бериллиевая бронза = Beryllium Copper | 865 - 955 | 1587 - 1750 |
| Бронза марганцовистая = Manganese bronze | 865 - 890 | 1590 - 1630 |
| Ванадий (V), Vanadium | 1900 | 3450 |
| Висмут (Bi) = Bismuth | 271.4 | 520.5 |
| Вольфрам (W), Tungsten | 3400 | 6150 |
| Железо ковкое (Fe) = Carbon Steel | 1482 - 1593 | 2700 - 2900 |
| Золото (Au) чистое 999 пробы 100% золото = Gold 24K Pure | 1063 | 1945 |
| Инконель, жаропрочный никелехромовый сплав = Inconel | 1390 - 1425 | 2540 - 2600 |
| Инколой, жаропрочный никелехромовый сплав = Incoloy | 1390 - 1425 | 2540 - 2600 |
| Иридий (Ir), Iridium | 2450 | 4440 |
| Кадмий (Cd) = Cadmium | 321 | 610 |
| Калий (K) = Potassium | 63.3 | 146 |
| Кобальт (Co) = Cobalt | 1495 | 2723 |
| Кремний (Si) = Silicon | 1411 | 2572 |
| Латунь желтая = Brass, Yellow | 905-932 | 1660-1710 |
| Латунь морская = Морская латунь (29-30% Zn, 70% Cu-1% Sn и 0,02-0,05% As) = Admiralty Brass | 900 - 940 | 1650 - 1720 |
| Латунь красная = Brass, Red | 990 - 1025 | 1810 - 1880 |
| Медь (Cu) = Copper | 1084 | 1983 |
| Мельхиор, купроникель = Cupronickel | 1170 - 1240 | 2140 - 2260 |
| Магний (Mg), Magnesium | 650 | 1200 |
| Магниевые сплавы = Magnesium Alloy | 349 - 649 | 660 - 1200 |
| Марганец (Mn), Manganese | 1244 | 2271 |
| Молибден (Mo), Molybdenum | 2620 | 4750 |
| Монель (до 67 % никеля и до 38 % меди) = Monel | 1300 - 1350 | 2370 - 2460 |
| Натрий (Na) = Sodium | 97.83 | 208 |
| Никель (Ni), Nickel | 1453 | 2647 |
| Ниобий (Nb), Niobium (Columbium) | 2470 | 4473 |
| Олово (Sn), Tin | 232 | 449.4 |
| Осмий (Os), Osmium | 3025 | 5477 |
| Палладий (Pd), Palladium | 1555 | 2831 |
| Платина (Pt),Platinum | 1770 | 3220 |
| Плутоний (Pu), Plutonium | 640 | 1180 |
| Рений (Re), Rhenium | 3186 | 5767 |
| Родий (Rh) = Rhodium | 1965 | 3569 |
| Ртуть (Hg) = Mercury | -38.86 | -37.95 |
| Рутений (Ru) = Ruthenium | 2482 | 4500 |
| Селен (Se) = Selenium | 217 | 423 |
| Cеребро 900 пробы = Coin Silver | 879 | 1615 |
| Серебро (Ar) чистое = Pure Silver | 961 | 1761 |
| Cеребро 925 пробы = Sterling Silver | 893 | 1640 |
| Свинец (Pb), Lead | 327.5 | 621 |
| Сталь углеродистая = Carbon Steel | 1425 - 1540 | 2600 - 2800 |
| Сталь нержавеющая = Stainless Steel | 1510 | 2750 |
| Сурьма (Sb) = Antimony | 630 | 1170 |
| Тантал (Ta) = Tantalum | 2980 | 5400 |
| Титан (Ti), Titanium | 1670 | 3040 |
| Торий (Th), Thorium | 1750 | 3180 |
| Уран (U), Uranium | 1132 | 2070 |
| Фосфор (P), Phosphorus | 44 | 111 |
| Хастелой С, Hastelloy C (54,5-59,5% Ni; 15-19% Mo; 0,04-0,15% C; 4-7% Fe; 13-16% Cr; 3,5-5,5% W) | 1320 - 1350 | 2410 - 2460 |
| Хром (Cr) = Chromium | 1860 | 3380 |
| Цинк (Zn), Zinc | 419.5 | 787 |
| Цирконий (Zr), Zirconium | 1854 | 3369 |
| Чугун серый = Grey Cast Iron | 1127 - 1204 | 2060 - 2200 |
| Чугун Ковкий, Ductile Iron | 1149 | 2100 |
В металлургической промышленности одним из основных направлений считается литье металлов и их сплавов по причине дешевизны и относительной простоты процесса. Отливаться могут формы с любыми очертаниями различных габаритов, от мелких до крупных; это подходит как для массового, так и для индивидуального производства.
Литье является одним из древнейших направлений работы с металлами, и начинается примерно с бронзового века: 7−3 тысячелетия до н. э. С тех пор было открыто множество материалов, что приводило к развитию технологии и повышению требований к литейной промышленности.
В наши дни существует много направлений и видов литья, различающихся по технологическому процессу. Одно остается неизменным - физическое свойство металлов переходить из твердого состояния в жидкое, и важно знать то, при какой температуре начинается плавление разных видов металлов и их сплавов.
Данный процесс обозначает собой переход вещества из твердого состояния в жидкое. При достижении точки плавления металл может находиться как в твердом, так и в жидком состоянии, дальнейшее возрастание приведет к полному переходу материала в жидкость.
То же самое происходит и при застывании - при достижении границы плавления вещество начнет переходить из жидкого состояния в твердое, и температура не изменится до полной кристаллизации.
При этом следует помнить, что данное правило применимо только для чистого металла. Сплавы не имеют четкой границы температур и совершают переход состояний в некотором диапазоне :
Точно измерить температуру плавления таких веществ невозможно, точкой перехода состояний указывается числовой промежуток.
В зависимости от температуры, при которой начинается плавление металлов, их принято разделять на :
Также существует и температура кипения - точка, при достижении которой расплавленный металл начнет переход в газообразное состояние. Это очень высокая температура, как правило, в 2 раза превышающая точку расплава.
Температура плавления и равная ей температура затвердевания зависят от давления, возрастая с его повышением. Это обусловлено тем, что при повышении давления атомы сближаются между собой, а для разрушения кристаллической решетки их нужно отдалить. При повышенном давлении требуется большая энергия теплового движения и соответствующая ей температура плавления увеличивается.
Существуют исключения, когда температура, необходимая для перехода в жидкое состояние, при повышенном давлении уменьшается. К таким веществам относят лёд, висмут, германий и сурьма.
Любому человеку, связанному с металлургической промышленностью, будь то сварщик, литейщик, плавильщик или ювелир, важно знать температуры, при которых происходит расплав материалов, с которыми он работает. В нижеприведенной таблице указаны точки плавления наиболее распространенных веществ.
Таблица температур плавления металлов и сплавов
Помимо таблицы плавления, существует много других вспомогательных материалов. Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
 Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность - возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа - Мега Паскалях.
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность - возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа - Мега Паскалях.
Существуют следующие группы прочности металлов :
Таблица прочности металлов
 Как видно из таблицы, точки плавления элементов сильно разнятся даже у часто встречающихся в быту материалов.
Как видно из таблицы, точки плавления элементов сильно разнятся даже у часто встречающихся в быту материалов.
Так, минимальная температура плавления у ртути -38,9 °C, поэтому в условиях комнатной температуры она уже в жидком состоянии. Именно этим объясняется то, что бытовые термометры имеют нижнюю отметку в -39 градусов Цельсия: ниже этого показателя ртуть переходит в твердое состояние.
Припои, наиболее распространенные в бытовом применении, имеют в своем составе значительный процент содержания олова, имеющего точку плавления 231.9 °C, поэтому большая часть припоев плавится при рабочей температуре паяльника 250−400°C.
Помимо этого, существуют легкоплавкие припои с более низкой границей расплава, до 30 °C и применяются тогда, когда опасен перегрев спаиваемых материалов. Для этих целей существуют припои с висмутом, и плавка данных материалов лежит в интервале от 29,7 - 120 °C.
Расплавление высокоуглеродистых материалов в зависимости от легирующих компонентов лежит в границах от 1100 до 1500 °C.
Точки плавления металлов и их сплавов находятся в очень широком температурном диапазоне, от очень низких температур (ртуть) до границы в несколько тысяч градусов. Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере. Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Каждый металл и сплав имеет собственный уникальный набор физических и химических свойств, среди которых не последнее место занимает температура плавления. Сам процесс означает переход тела из одного агрегатного состояния в другое, в данном случае, из твердого кристаллического состояния в жидкое. Чтобы расплавить металл, необходимо подводить к нему тепло до достижения температуры плавления. При ней он все еще может оставаться в твердом состоянии, но при дальнейшем воздействии и повышении тепла металл начинает плавиться. Если температуру понизить, то есть отвести часть тепла, элемент затвердеет.
Самая высокая температура плавления среди металлов принадлежит вольфраму : она составляет 3422С о, самая низкая - у ртути: элемент плавится уже при - 39С о. Определить точное значение для сплавов, как правило, не представляет возможности: оно может значительно колебаться в зависимости от процентного соотношения компонентов. Их обычно записывают в виде числового промежутка.
Плавление всех металлов происходит примерно одинаково - при помощи внешнего или внутреннего нагревания. Первый осуществляется в термической печи, для второго используют резистивный нагрев при пропускании электрического тока или индукционный нагрев в высокочастотном электромагнитном поле. Оба варианта воздействуют на металл примерно одинаково.
При увеличении температуры увеличивается и амплитуда тепловых колебаний молекул , возникают структурные дефекты решетки, выражающиеся в росте дислокаций, перескоке атомов и других нарушениях. Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела. Период разрушения решетки и накопления дефектов называется плавлением.
В зависимости от температуры плавления металлы делятся на:
В зависимости от температуры плавления выбирают и плавильный аппарат . Чем выше показатель, тем прочнее он должен быть. Узнать температуру нужного вам элемента можно из таблицы.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости. Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны .
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути - она плавится даже при -39 °C, самая высокая у вольфрама - 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой - плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты . Воздействие при этом примерно одинаковое.
Когда происходит нагревание , усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки , сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина - градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
 Металлы и сплавы - непременная основа для ковки , литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота , ограды из чугуна, ножи из стали или браслеты из меди) , для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Металлы и сплавы - непременная основа для ковки , литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота , ограды из чугуна, ножи из стали или браслеты из меди) , для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Как понятно из этой части таблицы, самый легкоплавкий металл - ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия - 2519 °C , у железа - 2900 °C, у меди - 2580 °C, у ртути - 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов - у рения - 5596 °C . Наибольшая температура кипения - у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов . Самым лёгким металлом является литий, самым тяжёлым - осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа - очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах - это теплопроводность металлов . Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл - серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
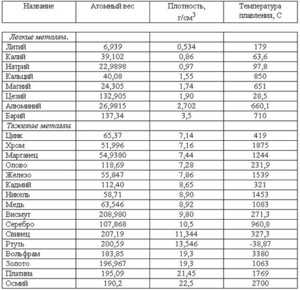
Температура плавления, наряду с плотностью, относится к физическим характеристикам металлов . Температура плавления металла - температура, при которой металл переходит из твердого состояния, в котором находится в нормальном состоянии (кроме ртути), в жидкое состояние при нагревании. При плавлении объем металла практически не изменяется, поэтому на температуру плавления нормальное атмосферное давление не влияет .
Температура плавления металлов находится в диапазоне от -39 градусов Цельсия до +3410 градусов . Для большинства металлов температура плавления высокая, однако, некоторые металлы можно расплавить в домашних условиях при нагревании на обычной горелке (олово, свинец).
| Металл | Температура плавления, градусов Цельсия |
| Алюминий | 660,4 |
| Вольфрам | 3420 |
| Дюралюмин | ~650 |
| Железо | 1539 |
| Золото | 1063 |
| Иридий | 2447 |
| Калий | 63,6 |
| Кремний | 1415 |
| Латунь | ~1000 |
| Легкоплавкий сплав | 60,5 |
| Магний | 650 |
| Медь | 1084,5 |
| Натрий | 97,8 |
| Никель | 1455 |
| Олово | 231,9 |
| Платина | 1769,3 |
| Ртуть | –38,9 |
| Свинец | 327,4 |
| Серебро | 961,9 |
| Сталь | 1300-1500 |
| Цинк | 419,5 |
| Чугун | 1100-1300 |
При плавлении металла для изготовления металлических изделий-отливок от температуры плавления зависит выбор оборудования, материала для формовки металла и др. Следует также помнить, что при легировании металла другими элементами температура плавления чаще всего снижается .
Интересный факт
Не стоит путать понятия "температура плавления металла" и "температура кипения металла" - для многих металлов эти характеристики существенно отличаются: так, серебро плавится при температуре 961 градус по Цельсию, а закипает только при достижении нагрева до 2180 градусов.
Температура плавления металла – это минимальная температура, при которой он переходит из твердого состояния в жидкое. При плавлении его объем практически не изменяется. Металлы классифицируют по температуре плавления в зависимости от степени нагревания.
Легкоплавкие металлы имеют температуру плавления ниже 600°C. Это цинк, олово, висмут. Такие металлы можно расплавить в домашних условиях, разогрев их на плите, или с помощью паяльника. Легкоплавкие металлы используются в электронике и технике для соединения металлических элементов и проводов для движения электрического тока. Температура плавления олова составляет 232 градуса, а цинка – 419.
Среднеплавкие металлы начинают переходить из твердого в жидкое состояние при температуре от 600°C до 1600°C. Они используются для изготовления плит, арматур, блоков и других металлических конструкций, пригодных для строительства. К этой группе металлов относятся железо, медь, алюминий, они также входят в состав многих сплавов. Медь добавляют в сплавы драгоценных металлов, таких как золото, серебро, платина. Золото 750 пробы на 25% состоит из лигатурных металлов, в том числе и меди, которая придает ему красноватый оттенок. Температура плавления этого материала равна 1084 °C. А алюминий начинает плавиться при относительно низкой температуре, составляющей 660 градусов Цельсия. Это легкий пластичный и недорогой металл, который не окисляется и не ржавеет, поэтому широко используется при изготовлении посуды. Температура плавления железа равна 1539 градусов. Это один из самых популярных и доступных металлов, его применение распространено в строительстве и автомобильной промышленности. Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Температура тугоплавких металлов выше 1600°C. Это вольфрам, титан, платина, хром и другие. Их используют в качестве источников света, машинных деталей, смазочных материалов, а также в ядерной промышленности. Из них изготавливают проволоки, высоковольтные провода и используют для расплавки других металлов с более низкой температурой плавления. Платина начинает переходить из твердого в жидкое состояние при температуре 1769 градусов, а вольфрам – при температуре 3420°C.
Ртуть – единственный металл, находящийся в жидком состоянии при обычных условиях, а именно, нормальном атмосферном давлении и средней температуре окружающей среды. Температура плавления ртути составляет минус 39°C. Этот металл и его пары являются ядовитыми, поэтому он используется только в закрытых емкостях или в лабораториях. Распространенное применение ртути – градусник для измерения температуры тела.
Металлы плавятся, как правило, при очень высокой температуре, которая может достигать более 3 тыс. градусов. Хотя некоторые из них можно расплавить в домашних условиях, например, свинец или олово. А вот ртуть плавят при температуре минус 39 градусов. В домашних условиях этого добиться не удастся. Температура плавления - это один из важных показателей производства не только самого металла, но и его сплавов. Выплавляя сырье, специалисты учитывают и другие физические и химические свойства руды и металла.
Железо - это химический элемент, который в таблице Менделеева находится под номером 26. Это один из самых распространенных элементов во всей Солнечной системе. Согласно материалам исследований, в составе ядра Земли находится примерно 79−85% этого вещества . В земной коре его тоже присутствует большое количество, но оно уступает алюминию.
В чистом виде металл имеет белый цвет с чуть серебристым оттенком. Он пластичен, но имеющиеся в нем примеси могут определять его физические свойства. Реагирует на магнит.
Железо присутствует в воде. В речных водах его концентрация равна примерно 2 мг/л металла. В морской воде его содержание может быть ниже в сто или даже тысячу раз.
Оксид железа - это основная форма, добыча которой осуществляется и которая находится в природе. Оксидное железо может располагаться в самой верхней части земной коры и быть составляющей осадочных образований.
Элемент, находящийся на двадцать шестом месте в таблице Менделеева, может иметь несколько степеней окисления. Именно они определяют его геохимическую особенность нахождения в определенной среде. В ядре Земли металл присутствует в нейтральной форме.
Руд, в которых присутствует железо, существует несколько. Однако, в качестве сырья для производства железа в промышленности используют в основном следующие:
А также часто встречаются такие разновидности руды:

Существует еще минерал под названием мелантерит . Его используют преимущественно в фармацевтической промышленности. Из себя он представляет зелёного цвета хрупкие кристаллы, в которых присутствует стеклянный блеск. Из него производят лекарственные препараты, в составе которых имеется ферум.
Основным месторождением этого металла является Южная Америка, а именно Бразилия.
Точкой плавления металла называют такую минимальную температуру, при которой он переходит из твердого состояния в жидкое. При этом в объеме он практически остается неизменным.
Металл могут производить из руды различными способами, но самый основной из них - это доменный . Помимо доменного, используют еще выплавку железа при помощи обжига измельченной руды с примесью глины. Из полученной смеси формируют окатыши, которые обрабатываются в печи с последующим восстановлением водородом. Далее плавление железа осуществляется в электрической печи.
Температура плавления железа весьма высока. Для технически чистого элемента она составляет +1539 °C. В этом веществе присутствует примесь - Сера, которую можно извлечь лишь в жидком виде. Без примесей чистый материал получают при электролизе солей металла.
Разные металлы могут переходить в жидкое состояние при разной температуре. Вследствие этого выделяют определённую классификацию. Их делят следующим образом:
Единственный элемент, который при обычных условиях находится в жидком состоянии - это ртуть. Температура его плавления составляет минус 39 градусов и его пары являются ядовитыми, поэтому его используют только в лабораториях и закрытых ёмкостях.
Температуру плавления металлов, которая изменяется от малейшего (-39 °С для ртути) до наибольшего (3400 °С для вольфрама), а также плотность металлов в твердом состоянии при 20 °С и плотности жидких металлов при температуре плавления приведены в таблице плавки цветных металлов.
Таблица 1. Плавки цветных металлов
Атомная масса | Температура плавления t пл , °С | Густота ρ , г/см 3 | ||
твердого при 20 °С | редкого при t пл | |||
Алюминий | ||||
Вольфрам | ||||
Марганец | ||||
Молибден | ||||
Цирконий | ||||
Сварка меди . Температура плавки металла Cu, почти в шесть раз превышает температуру плавки стали, медь интенсивно поглощает и растворяет различные газы, образуя с кислородом оксиды. Оксид меди II с медью образует эвтектику, температура плавления которой (1064°С) ниже температуры плавления меди (1083°С). При затвердевании жидкой меди эвтектика располагается по границам зерен, делает медь хрупкой и склонной к образованию трещин. Поэтому основной задачей при сварке меди является защита его от окисления и активное раскисление сварочной ванны.
Наиболее распространенное газовое сварки меди ацетиленокисневим пламенем с помощью горелок, которые в 1,5…2 раза мощнее горелки для сварки сталей. Присадочным металлом есть медные прутки, содержащие фосфор и кремний. Если толщина изделий более 5…6 мм, их сначала подогревают до температуры 250…300°С. Флюсами при сварке является прожаренная бура или смесь, состоящую из 70% буры и 30% борной кислоты. Чтобы повысить механические свойства и улучшить структуру наплавленного металла, медь после сварки проковывают при температуре около 200…300°С. Потом ее снова нагревают до 500-550°С и охлаждают в воде. Медь сваривают также электродуговым способом электродами, в струе защитных газов, под слоем флюса, на конденсаторных машинах, способом трения.
Сварка латуни . Латунь – это сплав меди с цинком (до 50%). Основное загрязнение при этом – испарение цинка, в итоге чего шов теряет свои качества, в нем возникают поры. Латунь, как и медь, в основном сваривают ацетиленовым окислительным пламенем, при котором на поверхности ванны создается пленка тугоплавкого оксида цинка, уменьшающая дальнейшее выгорание и испарение цинка. Флюсы используют такие же, как и при сварке меди. Они создают на поверхности ванны шлаки, которые связывают оксиды цинка и затрудняют выход паров из сварочной ванны. Латунь сваривают также в защитных газах и на контактных машинах.
Сварка бронзы . В большинстве случаев бронза – это литейный материал, поэтому
сварку применяют при исправлении дефектов или во время ремонта. Чаще всего применяют сварку металлическим электродом. Присадочным металлом является прутки того самого состава, что и основной металл, а флюсами или электродным покрытием – хлористые и фтористые соединения калия и натрия.
. Основными факторами, затрудняющими сварку алюминия, является низкая температура его плавления (658°С), большая теплопроводность (примерно в 3 раза выше теплопроводности стали), образование тугоплавких оксидов алюминия, которые имеют температуру плавления 2050°С, поэтому технология плавки цветных металлов, таких как медь или бронза, не подходит для плавки алюминия. Кроме того, эти оксиды слабо реагируют как с кислыми, так и основными флюсами, поэтому плохо удаляются из шва.

Чаще всего используют газовую сварку алюминия ацетиленовым пламенем. В последние годы значительно распространилось также автоматическая дуговая сварка металлическими электродами под флюсом и в среде аргона. При всех способах сварки, кроме аргонодуговой, применяют флюсы или электродные покрытия, в состав которых входят фтористые и хлористые соединения лития, калия, натрия и других элементов. Как присадочный металл при всех способах сварки используют проволоку или стержни того же состава, что и основной металл.
Алюминий хорошо сваривается электронным лучом в вакууме, на контактных машинах, электрошлаковым и другими способами.
Сварка сплавов алюминия . Сплавы алюминия с магнием и цинком сваривают без
особых осложнений, так же как и алюминий. Исключением является дюралюминий – сплавы алюминия с медью. Эти сплавы термически упрочняются после закалки и следующего старения. Когда температура плавки цветных металлов свыше 350°С в них происходит снижение прочности, которое не восстанавливается термической обработкой. Поэтому при сварке дюралюминия в зоне термического влияния прочность уменьшается на 40…50%. Если дюралюминий сваривать в защитных газах, то такое снижение может быть восстановлено термической обработкой до 80…90% по отношению к прочности основного металла.
Сварка магниевых сплавов . При газовой сварке обязательно применяют фторидные флюсы, которые в отличие от хлоридных не вызывают коррозии сварных соединений. Дуговая сварка магниевых сплавов металлическими электродами через низкое качество сварных швов до настоящего времени не применяется. При сварке магниевых сплавов наблюдается значительный рост зерна в около шовных участках и сильное развитие столбчатых кристаллов в сварном шве. Поэтому предел прочности сварных соединений составляет 55…60% предела прочности основного металла.
Таблица 2. Физические свойства промышленных цветных металлов
Свойства | М еталл | |||||||||||
Атомный номер | ||||||||||||
Атомная масса | ||||||||||||
при температурте 20 °С, кг/м 3 | ||||||||||||
Температура плавления, °С | ||||||||||||
Температура кипения, °С | ||||||||||||
Атомный диаметр, нм | ||||||||||||
Скрытая теплота плавления, кДж/кг | ||||||||||||
Скрытая теплота испарения, | ||||||||||||
Удельная теплоемкость при температуре 20 °С, Дж/(кг .°С) | ||||||||||||
Удельная теплопроводность, 20 °С, Вт/(м —°С) | ||||||||||||
Коэффициент линейного расширения при температуре 25 °С, 10 6 — ° С — 1 | ||||||||||||
Удельное электросопротивление при температуре 20°С, мкОм —м | ||||||||||||
Модуль нормальной упругости, ГПа | ||||||||||||
Модуль сдвига, ГПа | ||||||||||||
Неотъемлемой составляющей производства металла и металлических изделий, является использование во время производственного процесса тиглей для производства, выплавки и переплавки как черного, так и цветного металла. Тигли - это неотъемлемая часть металлургического оборудования при отливании разнообразных металлов, сплавов, и тому подобное.
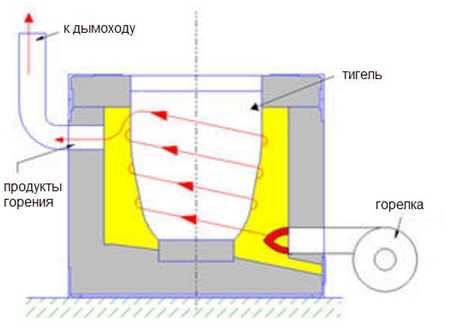
Керамический тигель для плавки цветных металлов используется для плавки металлов (меди, бронзы) с древнейших времен.
C проблемой, как расплавить медь в домашних условиях, сталкиваются многие хозяева. Одни хотят отлить медные изделия, у других скопился медный лом, который занимает много места, а выбросить его жаль. Тех, кто считает, что это сложный процесс и расплавить медь в домашних условиях не получится, можно успокоить. Древние люди умели это делать за несколько веков до н.э., не имея для этого никаких специальных приспособлений.
Среди металлов, нашедших широкое применение в промышленности, это среднее значение. Олово, свинец, магний, цинк, алюминий имеют существенно меньшую и золота она равна соответственно 960 °С и 1063 °C. У железа температура плавления равна 1539 °С. Поэтому медь, серебро и золото можно плавить в железной посуде. Добавление олова, свинца и цинка позволяет существенно снизить температуру плавления меди, но при этом образуется не чистая - бронза и латунь.
До начала плавления необходимо подготовить:
Крючок можно изготовить из стальной проволоки. Формой может служить любая стальная емкость, можно подготовить углубление в земле, как это делали наши предки. Для художественного литья потребуется специальная форма.
Приобретать дорогостоящую муфельную печь ради одной плавки не стоит. Медь можно расплавить другими способами.
Расплавить медь можно с помощью газовой горелки
У некоторых автолюбителей в гаражах имеются самодельные горны, с помощью которых можно плавить металлы. Если горн найти не удалось, его можно сделать своими руками.
Медные сплавы бронзу и латунь можно расплавить с помощью газовой горелки автогенной сварки или паяльной лампой с насадкой для поворота пламени. Пламя должно нагревать тигель равномерно снизу.
Медные заготовки
Сегодня медь является одним из самых востребованных металлов. Высокий спрос объясняется отличительными характеристиками, присущими этому металлу. Медь проводит электроток лучше любых других металлов, кроме серебра, благодаря этому ее используют в производстве кабелей и электропроводов. Температура плавления меди не высокая, металл пластичный и легко поддается обработке, благодаря этому качеству стало возможным ее применение в строительстве в качестве водопроводных тр. Этот металл имеет высокое сопротивление к внешним раздражающим факторам, поэтому долговечен и может быть использован несколько раз, после переплавки. Это качество меди высоко ценят экологи, поскольку при повторной обработке металла тратится значительно меньшее количество энергии, чем при добыче и обработки руды, к тому же сохраняются земные недра. Добыча медной руды не проходит бесследно, на месте отработанных рудников появляются токсичные озера, наиболее известное во всем мире такое озеро – Беркли-Пит в штате Монтана в США.
Медь не является легкоплавким металлом
Люди нашли применение меди еще в древние времена, тогда ее добывали в виде самородков. Ввиду низкой температуры, необходимой для осуществления процесса плавления ее стали широко применять для изготовления орудий труда и охоты, самородки можно плавить на костре. В наши дни технология получения металла мало чем отличается от придуманной в древние времена, совершенствуются лишь печи, увеличена скорость обжига и объемы обработки. Здесь возникает уместный вопрос — какая температура плавления меди? Ответ на него можно найти в любом учебнике по физике и химии – медь начинает плавиться при температуре нагрева до 1083 о С.
Кипение меди уменьшает ее прочность
В процессе термического воздействия на металл происходит разрушение его кристаллической решетки, это достигается при определенной температуре, которая в течение некоторого времени остается постоянной. В этот момент и происходит плавка металла. Когда процесс разрушения кристаллов полностью завершен, температура металла снова начинает подниматься, и он переходит в жидкую форму и начинает кипеть. Температура плавления меди значительно ниже, чем та, при которой металл кипит. Процесс кипения начинается с появлением пузырьков, по аналогии с водой. На этом этапе любой металл, в том числе и медь, начинает терять свои характеристики, в основном это отражается на прочности и упругости. Температура кипения меди составляет 2560 о С. Во время остывания металла происходит похожая картина, как и при нагреве – сначала температура опускается до определенного градуса, в этот момент происходит затвердевание, которое длится некоторое время, затем продолжается остывание до обычного состояния.
Любой нагрев меди влечет за собой изменение ее характеристик, наиболее значимой является величина ее удельного сопротивления. Медь является проводником электрического тока, при этом металл оказывает сопротивление движению носителям заряда. Отношение площади сечения проводника к оказываемому движению и называется удельным сопротивлением.
Так вот, эта величина для чистой меди составляет 0,0172 ОМ мм 2 /м при 20 о С. Этот показатель может измениться после термической обработки, а также вследствие добавления в состав различных примесей и добавок. Здесь наблюдается обратная зависимость сопротивления меди от температуры – чем выше была температура обработки металла, тем ниже будет ее сопротивление электрическому току. Для обеспечения наилучших электролитических характеристик медной проволоки, ее обрабатывают при 500 о С.
Во время термической обработки можно не только придавать металлу нужную форму и размер, но и создавать различные сплавы. Самыми распространёнными медными сплавами является бронза и латунь. Бронза получается путем смешивания меди с оловом, а латунь – с цинком. Добавление алюминия и стали увеличивает прочность материала, а добавление никеля повышает антикоррозийные свойства. Но стоит заметить, что любая примесь снижает главное свойство – электропроводность, поэтому для изготовления жил электрокабеля используют чистый состав металла.
Под отжигом меди следует понимать процесс ее нагрева с целью дальнейшей обработки и приданию необходимых форм изделию. В ходе отжига металл становится более пластичным и мягким, поддающимся различным трансформациям. При отжиге меди температура достигает 550 о С, она приобретает темно-красный оттенок. После нагрева желательно быстро производить ковку и оправлять изделие на охлаждение.
Если подвергать материал медленному, естественному охлаждению, то возможно образование наклепа, поэтому чаще применяют мгновенное охлаждение путем помещения заготовки в холодную воду. Если превысить допустимую величину нагрева, металл может стать более хрупким и ломким.
Во время отжига осуществляется процесс рекристаллизации меди, в ходе которого образуются новые зерна или кристаллы металла, которые не искажены решеткой и отделены от прежних зерен угловыми границами. Новые зерна по размеру могут сильно отличаться от предшественников, при их образовании высвобождается большое количество энергии, увеличивается плотность и появляется наклеп. Рекристаллизация осуществляется только после деформации изделия, и только после достижения ее определенного уровня. Для меди критический уровень деформации составляет 5%, если он не достигнут процесс формирования новых зерен не начнется. Температура рекристаллизации меди составляет 270 о С. Следует отметить, что при этой температуре процесс роста кристаллов только начинается, но он достаточно медленный, поэтому для достижения необходимого результата медь необходимо нагреть до 500 о С, тогда времени для остывания хватит для завершения процесса рекристаллизации.
Каждый металл обладает способностью плавиться. Все они отличаются собственной температурой плавления, которая зависит от разных факторов. Прежде всего, на этот показатель влияет структура металла и наличие в нем каких-либо примесей. Температура плавления меди составляет 1084 градуса.
Во время нагревания металлов их кристаллическая решетка начинает постепенно разрушаться. В начальной стадии, по мере нагревания, происходит повышение температуры. Достигнув определенного значения, она продолжает оставаться на одном и том же уровне, несмотря на продолжающийся нагрев. В такой момент и начинается процесс плавления. Он продолжается до тех пор, пока металл полностью не расплавится. После этого продолжается дальнейшее повышение температуры. Таким образом, происходит плавление всех, без исключения, металлов.
Во время охлаждения наблюдается обратное явление. Температура начинает снижаться до тех пор, пока металл не начнет твердеть. Она будет держаться на одном уровне до окончательного отвердения, а потом вновь начнет понижаться. Все происходящие процессы можно отобразить графически, в виде фазовой диаграммы. Она точно показывает состояние вещества при воздействии на него определенной температуры.
Если же расплавленный металл будет нагреваться и далее, то при достижении определенного предела он начнет кипеть. Однако в отличие от жидкости, жидкий металл начинает выделять не пузырьки газа, а углерод, который образуется во время окислительных процессов.
Человек использовал медь для своих целей с древних времен. Плавление меди при сравнительно низких температурах, позволило проводить с этим металлом самые разные операции. Таким образом, была получена бронза, представляющая собой сплав меди с оловом. По своей прочности она значительно превосходила чистую медь, что позволило изготавливать более качественное оружие и инструменты.
В настоящее время медь также не используется в чистом виде. В составе меди, в большом количестве присутствуют разные компоненты. Их содержание достигает 1%. В качестве основных добавок используется никель, железо, мышьяк и сурьма. Тем не менее, несмотря на добавки, с технической стороны медь считается чистым металлом с высокими показателями теплопроводности и электропроводности. Поэтому она является идеальным материалом для кабельно-проводниковой продукции.
Относительно невысокая температура плавления меди составляет 1084°С. Это позволяет получать на ее основе металлические сплавы, обладающие совершенно другими свойствами.
Среди них хорошо известна латунь, представляющая собой сплав меди и цинка, в процентном соотношении приблизительно 1:1. Полученное вещество, имеет более низкую температуру плавления, составляющую от 800 до 950 градусов. Конкретное значение этого показателя зависит от соотношения металлов, содержащихся в сплаве: с уменьшением количества цинка плавление латуни происходит при более низкой температуре. Данный материал используется в литейном производстве, а также в качестве листовых и прокатных изделий. Кроме цинка, в различные марки латуни добавляются другие компоненты, влияющие на процесс плавления.
Другим известным сплавом является бронза, в которой присутствует медь и олово. В некоторых случаях, вместо олова могут использоваться железные, алюминиевые или марганцевые добавки. Сплав с оловом плавится при диапазоне от 900 до 950 градусов. Для бронзы без олова этот показатель составляет от 950 до 1080 градусов. Этот материал применяется для производства различных трущихся деталей, а также при изготовлении декоративных украшений.
Благодаря тому, что температура плавления меди достаточно невысокая, этот металл стал одним из первых, которые древние люди начали использовать для изготовления различных инструментов, посуды, украшений и оружия. Самородки меди или медную руду можно было расплавить на костре, что, собственно, и делали наши далекие предки.
Несмотря на активное применение человечеством с древних времен, медь не является самым распространенным природным металлом. В этом отношении она значительно уступает остальным элементам и занимает в их ряду только 23-е место.
Благодаря невысокой температуре , составляющей 1083 градуса Цельсия, наши далекие предки не только успешно получали из руды чистый металл, но и изготавливали различные сплавы на его основе. Чтобы получить такие сплавы, медь нагревали и доводили до жидкого расплавленного состояния. Затем в такой расплав просто добавляли олово или выполняли его восстановление на поверхности расплавленной меди, для чего использовалась оловосодержащая руда (касситерит). По такой технологии получали бронзу – сплав, обладающий высокой прочностью, который использовали для изготовления оружия.
Что характерно, температуры плавления меди и сплавов, полученных на ее основе, отличаются. При , имеющего меньшую температуру плавления, получают бронзу с температурой плавления 930–1140 градусов Цельсия. А сплав меди с цинком (латунь) плавится при 900–10500 Цельсия.
Во всех металлах в процессе плавления происходят одинаковые процессы. При получении достаточного количества теплоты при нагревании кристаллическая решетка металла начинает разрушаться. В тот момент, когда он переходит в расплавленное состояние, его температура не повышается, хотя процесс передачи ему теплоты при помощи нагрева не прекращается. Температура металла начинает вновь повышаться только тогда, когда он весь перейдет в расплавленное состояние.
При охлаждении происходит противоположный процесс: сначала температура резко снижается, затем на некоторое время останавливается на постоянной отметке. После того, как весь металл перейдет в твердую фазу, температура снова начинает снижаться до полного его остывания.
Как плавление, так и обратная кристаллизация меди, связаны с параметром удельной теплоты. Данный параметр характеризует удельное количество теплоты, которая требуется для того, чтобы перевести металл из твердого состояния в жидкое. При кристаллизации металла такой параметр характеризует количество теплоты, которое он отдает при остывании.
Более подробно узнать о плавлении меди помогает фазовая диаграмма, показывающая зависимость состояния металла от температуры. Такие диаграммы, которые можно составить для любых металлов, помогают изучать их свойства, определять температуры, при которых они кардинально меняют свои свойства и текущее состояние.
Кроме температуры плавления, у меди есть и температура кипения, при которой расплавленный металл начинает выделять пузырьки, наполненные газом. На самом деле никакого кипения меди не происходит, просто этот процесс внешне очень его напоминает. Довести до такого состояния ее можно, если нагреть до температуры 2560 градусов.
Как понятно из всего вышесказанного, именно невысокую температуру плавления меди можно назвать одной из основных причин того, что сегодня мы можем использовать этот металл, обладающий многими уникальными характеристиками.
Если вас хоть раз волновал вопрос о температуре плавления бронзы, то данная статья именно для вас. Некоторые исторические данные дают право полагать, что первобытные люди имели в обиходе медь, но она была в самородках, которые иногда могли быть внушительных размеров.
Название «медь» (на латыни «Cuprum») происходит от названия острова Кипр, на котором и добывали этот металл древние греки. Ввиду того, что медь имеет не слишком высокую температуру плавления, медную руду или сами самородки в древности плавили на костре. А медь использовали в оружейном деле, а также для изготовления разных предметов обихода. По наличию и распространению в земной толще медь находится на 23 месте относительно иных элементов, однако люди начали применять ее еще в древние времена. Как правило, в природе медь встречается в соединениях сульфидных руд, самыми популярными из которых считаются медный колчедан и медный блеск.
Технологии для получения меди существуют разные. Но каждая отдельная технология имеет не один этап. Медь получают из руды. Как сказано выше, температура плавления меди давала возможность даже древним людям справляться с ее обработкой. Само примечательное то, что уже в древности люди сумели выработать способ получения и дальнейшего применения как чистой меди, так и сплавов.
Процесс плавления – это изменение состояния металла от твердого к жидкому. Именно для этого и использовали костер, а благодаря низкой температуре плавления можно было проделать эту процедуру без особых сложностей. Для получения сплавов в расплавленную медь добавляли олово. Его можно было получить, восстановив из специальной оловосодержащей руды (касситерит). Такой сплав получил название бронза, которая намного прочнее меди. Бронзу также использовали в древности для изготовления оружия.
А также можно было добыть из медной руды при помощи плавления более чистый металл. Все знают, что каждый металл имеет свою температуру плавления, которая в свою очередь зависит от того, какое количество примесей присутствует в руде. Например, медь, у которой температура плавления равняется 1083 °С, при смешивании с оловом образует новый материал – бронзу. А температура плавления бронзы составляет 930-1140°С, а разная температура потому, что зависит от того, сколько в ней содержится олова. Ну а если вам интересно узнать подробнее, например, какой имеет бронза цвет или какой имеет бронза состав, то эту информацию также можно найти в интернете.
Например, латунь – это сплав цинка и меди с температурой плавления 900-1050°С. Когда металл нагревается и плавится, то кристаллические решетки начинают разрушаться. При процессе плавления температура метала постепенно повышается, а далее с определенной отметки становится постоянной, однако нагрев остается таким же. Вот в момент, когда температура останавливается на определенном значении, начинается процесс плавления. И в момент плавления металла температура остается на одном и том же значении, но когда металл полностью расплавлен, температура снова будет увеличиваться.
Такой процесс происходит относительно любого металла. Ну а в процессе охлаждения идет обратный процесс, а именно: сперва температура падает до того момента, пока металл не начнет затвердевать, а уже далее остается постоянной. Когда металл полностью затвердеет, температура снова начинает снижаться. Так ведут себя все металлы, изображая этот процесс графически, он будет иметь вид диаграммы с фазами, на которой четко будет видно состояние вещества на определенно температурной отметке.
Многие ученые пользуются такими фазовыми диаграммами в качестве главного инструмента для исследования процессов, происходящих с металлами при плавлении. Например, если уже расплавленный металл продолжать нагревать, то при достижении определенной температуре масса начнет кипеть. Например, медь кипит при температуре 2560 °С. Относительно металлов такой процесс также назвали кипением, поскольку по аналогии кипящей жидкости на его поверхности появляются пузыри газа.
Алюминий — это техническое название алюминия , который представляет собой химический элемент, принадлежащий к группе металлов. Интересно, что алюминий является третьим по распространенности элементом в земной коре — его весовое содержание составляет 8,13 % (сразу после кислорода — 46,1 % и кремния — 27,72 %). Алюминий — очень популярный строительный материал, но он также используется во многих других отраслях экономики. Сегодня мы проверим, при какой температуре плавится алюминий и каковы его общие физико-химические свойства.
Алюминий плавится при 660,32°С . Температура кипения этого элемента составляет целых 2519°С.
Можно ли плавить алюминий в домашних условиях? На самом деле это возможно, но довольно требовательно. Прежде всего следует иметь в виду, что этот элемент легко окисляется (пассивируется и покрывается слоем трехокиси алюминия), поэтому процесс переплавки следует проводить в защитной атмосфере.Таким образом, рассматриваемое покрытие придает алюминию коррозионную стойкость при нормальных условиях эксплуатации.
Интересен тот факт, что из алюминия делают емкости для хранения азотной кислоты. При контакте с этой кислотой она подвергается сильной пассивации и становится устойчивой к ее коррозионному воздействию.
отличается прежде всего малой плотностью и высокой пластичностью. Не вызывает проблем при литье и последующей обработке (не образует искр).Он хорошо проводит электрический ток, но хуже по своим механическим свойствам. Для усиления конструкций из алюминия применяют различные легирующие добавки. Интересен тот факт, что чистый алюминий отлично отражает видимый свет (99%) и инфракрасное излучение (95%).
В связи с тем, что чистый алюминий не обладает удовлетворительными механическими свойствами, обычно используются различные типы сплавов. Сочетание других металлов и алюминия делает все это дело даже в несколько раз прочнее.Интересно, что некоторые алюминиевые сплавы отлично подходят как для литья, так и для формовки. К наиболее популярным алюминиевым потолкам относится фехраль (хромаль), т.е. сочетание железа, хрома и алюминия – особенностью этого сплава является его стойкость к окислению и сере.
К сожалению, несмотря на хорошие механические свойства, алюминиевые сплавы обладают худшей коррозионной стойкостью по сравнению с чистым металлом. Это связано с тем, что чистый алюминий вступает в реакцию с кислородом воздуха и естественным образом покрывается белым налетом – оксидом алюминия.Добавление других ингредиентов ухудшает эти свойства – особенно неблагоприятны медь и кремний.
Фото: en.freepik.com
Главный редактор Joblife.pl
Уже 11 лет он занимается созданием специализированного консультативного контента. Его знания получены из многоязычных информационных каналов и научных энциклопедий.Лично я любитель горных путешествий и энтузиаст маркетинга.
.Температура плавления некоторых металлов и их сплавов и сталей в градусах Цельсия.
| Металл | Температура плавления |
|---|---|
| Латунь (Cu-69%, Zn 30%, Sn-1%) | 900 - 940 |
| Алюминий | 660 |
| Алюминиевые сплавы | 463 - 671 |
| Алюминиевая бронза | 600 - 655 |
| Сурьма | 630 |
| Берилл | 1285 |
| Медный берилл | 865 - 955 |
| Висмут | 271.4 |
| Латунь | 1000 - 930 |
| Кадмий | 321 |
| Серый чугун | 1175 - 1290 |
| Хром | 1860 |
| Кобальт | 1495 |
| Медь | 1084 |
| Мельхиор | 1170 - 1240 |
| Золото, 24К | 1063 |
| Хастеллой С | 1320 - 1350 |
| Инконель | 1390 - 1425 |
| Инколой | 1390 - 1425 |
| Иридий - Иридий | 2450 |
| Кованое железо | 1482 - 1593 |
| Чугун, серый чугун | 1127 - 1204 |
| Ковкий чугун | 1149 |
| Свинец | 327,5 |
| Магний | 650 |
| Магниевые сплавы | 349 - 649 |
| Марганец | 1244 |
| Марганцево-коричневый | 865 - 890 |
| Меркурий | 90 015-38.86|
| Молибден | 2620 |
| Монель | 1300 - 1350 |
| Никель | 1453 |
| Ниобий (колумбий) | 2470 |
| Осм | 3025 |
| Палладий | 1555 |
| Люминофор | 44 |
| Платина | 1770 |
| Плутон | 640 |
| Калий | 63.3 |
| Красная латунь | 990 - 1025 |
| Рен | 3186 |
| Стержень | 1965 |
| Рутений | 2482 |
| Селен | 217 |
| Кремний | 1411 |
| Серебро, Монета | 879 |
| Чистое серебро | 961 |
| Серебро 92,5% + надбавка | 893 |
| Натрий | 97.83 |
| Углеродистая сталь | 1425 - 1540 |
| Нержавеющая сталь | 1510 |
| Тантал | 2980 |
| Трек | 1750 |
| Олово | 232 |
| Титан | 1670 |
| Вольфрам | 3400 |
| Уран | 1132 |
| Ванадий | 1900 |
| Желтая латунь | 905 - 932 |
| Цинк | 419.5 |
| Циркон | 1854 |
Алюминий — металл второго ряда и группа 13 в периодической таблице. Это третий по распространенности элемент после кислорода и кремния, который можно найти в земной коре. Алюминий встречается в природе в виде соединений, но никогда не встречается в виде чистого металла. Процесс извлечения алюминия из его соединений сложен и достаточно трудоемок. Алюминий — полезный и широко используемый металл, известный своим легким весом, пластичностью и коррозионной стойкостью.Алюминий легче переработать, чем удалить руду. Он также достаточно безопасен при контакте с кожей и использовании рядом с едой.
Температура плавления вещества определяется как температура, при которой вещество переходит из твердого состояния в жидкое, но при заданном атмосферном давлении. Именно при температуре плавления жидкое и твердое состояния вещества находятся в равновесии.Однако температура плавления вещества зависит главным образом от давления; в эталонных материалах он часто специфичен при стандартном давлении. Точка плавления вещества также называется ликвидус, точка плавления или солидус. Температура плавления алюминия составляет 659 градусов Цельсия или 1218 градусов Цельсия.
Температура плавления вещества является важным физическим свойством. Основной целью определения температур кипения и плавления веществ в лабораторном опыте является использование результатов для выявления в этих веществах примесей или неизвестных веществ.Точка плавления неизвестного твердого вещества может использоваться для его идентификации путем сравнения его с различными другими потенциальными твердыми веществами и их точками плавления, благодаря чему твердое вещество может быть идентифицировано. Кроме того, цель знания температуры плавления вещества состоит в том, чтобы использовать диапазон его температур плавления, чтобы помочь определить его общую чистоту. Соответственно, чем больше интервал плавления вещества, тем менее чистым является вещество, чем больше диапазон плавления уменьшен, тем чище вещество.
Температура плавления вещества варьируется от одного вещества к другому. Например, в то время как кислород плавится при 218 градусах Цельсия, лед плавится при 0 градусах Цельсия, а алюминий — 219 градусов Цельсия. Следовательно, определенные вещи влияют на температуру плавления различных веществ. Факторы, влияющие на температуру плавления вещества, включают межмолекулярные силы, изменение температуры плавления ионных связей, форму молекул и размер молекул.Чистое кристаллическое соединение обычно имеет более точную температуру плавления и поэтому полностью плавится в небольшом интервале температур, не превышающем 0,5-1 градус Цельсия. Когда такое вещество содержит даже минимальное количество примесей, обычно в точках замерзания образуется углубление, свидетельствующее об увеличении ширины диапазона температур плавления. Если диапазон температур плавления превышает пять градусов, вещество загрязнено.
Алюминий — один из самых полезных металлов в мире.В чистом виде алюминий в основном используется в электронной промышленности для производства жестких дисков, токопроводящих дорожек на кремниевых чипах и фольги для конденсаторов. Когда металл сплавляется с другими металлами, такими как кремний, цинк, медь и магний, он становится еще прочнее. Еще одним важным применением алюминия является производство банок для напитков и пленок, используемых для консервирования пищевых продуктов, а также различных кухонных принадлежностей.
.90 000 американских ученых разработали супермет - tvp.infoКомбинация гафния, углерода и азота. В правильных пропорциях такой сплав обладает теоретически замечательными свойствами. Ученые американского Университета Брауна подсчитали, что температура плавления такого металла составит 4400 градусов Кельвина, или 4126 градусов Цельсия.
Обеспечение связью регионов, пострадавших от стихийных бедствий, является сложной задачей для служб: ее необходимо выполнять быстро, а природные условия...
увидеть большеЕсли удастся создать такой сплав и он будет обладать нужными свойствами, то это будет самое тугоплавкое вещество, известное человеку.Считающаяся стойкой, сталь плавится при температуре около 1500 градусов Цельсия, золото — около 1000 градусов Цельсия, а алюминий — всего 660 градусов Цельсия.
Ученые из Университета Род-Айленда использовали компьютерное моделирование для разработки новой формулы. Теперь они надеются синтезировать такой металл и подвергнуть его дальнейшим исследованиям.
Более дешевый метод
- Преимущество компьютерного моделирования заключается в том, что различные комбинации можно опробовать с меньшими затратами.Вместо того, чтобы искать в темноте, у нас есть шанс найти решение, о котором стоит позаботиться в лаборатории, — пояснил проф. Аксель ван де Валле из Университета Брауна.
В настоящее время наиболее устойчивым к плавлению веществом является сплав гафния, тантала и углерода. Он плавится при 3526 градусах Цельсия. Эти типы металлов в основном используются в теплозащитных экранах космических аппаратов и газовых турбинах.
источник: ежедневная почта.co.uk
#металл #Останавливаться #гафний #коричневый университет #азот #золото #алюминий . Крупнейшими производителями технического алюминия (почти 100%) в мире в настоящее время являются Китай, Россия, Индия и Канада.Наиболее эффективным методом производства является электролитическое рафинирование, хотя в металлургических целях применяют электролиз кислорода кислорода в расплавленном криолите.
Значительное, с точки зрения масштаба, использование алюминия также является упаковкой для продуктов питания и напитков, широко известной как банки.Консервированные в них продукты имеют длительный срок хранения, и, что немаловажно с точки зрения экологии, как раздельные отходы, они очень легко перерабатываются в новую упаковку. Алюминий как упаковка имеет ряд уникальных преимуществ: он нетоксичен, не впитывает свое содержимое и не склонен откалываться. Наконец, алюминий также в меньших количествах используется в производстве косметики и лекарств — в последних он обычно действует как нейтрализатор кислоты.
Алюминиевые банки используются для изготовления банок для еды и напитков. Источник: Shutterstock. Да, в организме каждого человека есть небольшое количество этого легкого металла, но, скорее всего, это лишь влияние окружающей среды. Каждый из нас вдыхает взвешенные в воздухе мельчайшие частицы алюминия в концентрации не более 0,005-0,0018 микрограммов на кубический метр.В промышленных зонах этот уровень может быть несколько выше, до 8 мкг на квадратный метр 3 .
Алюминий также присутствует в поверхностных водах, но в этом контексте он не считается опасным – на самом деле в питьевой воде его минимальное количество. Однако он также может попасть в наш организм через продукты питания, косметику и лекарства, и именно этот способ в последние годы стал причиной общественного беспокойства.

Диаграмма, показывающая потенциальные источники алюминия в окружающей среде человека; собственное исследование
У детей повышенное воздействие алюминия, в основном из пищевых источников, также связано с риском заболеваний скелета — алюминий в желудке затрудняет усвоение организмом фосфора, необходимого для правильного развития костей. Однако мы ничего не знаем о потенциальных врожденных дефектах, вызванных алюминием.Да, молодые животные оказываются более слабыми и менее подвижными, если их матери имели контакт с повышенными дозами алюминия во время беременности и грудного вскармливания, но этот факт сложно перевести в реальный риск присутствия алюминия в рационе и воздухе в таких малых количествах. суммы.
Взаимосвязь между использованием дезодорантов, содержащих алюминий, и риском развития рака молочной железы неясна. Ибо есть исследования, подтверждающие эту корреляцию, и другие, которые ей противоречат. Однако до сих пор алюминий не считается канцерогеном!

Алюминиевая фольга обычно используется для приготовления блюд, например.гриль. Источник: Shutterstock
Ekologia.pl (Агата Павлинец)
| Символ | Al |
| Название на языке. английский | алюминий |
| Latin | aluminum |
| Physical state | solid |
| Chemical nature | metal |
| Atomic number | 13 |
| Atomic mass | 26.98154 |
| Group number, period, power unit | 13 (IIIA), 3, p |
| Valuation | III |
| Simplified electron configuration | [Ne] 3s 2 3p 1 |
| Pauling electronegativity | 1.5 |
| Melting point [ o C] | 660.2 |
| Boiling point [90 004 o C] | 2447 |
| Density [g / cm 3 ] | 2.70 |
Алюминий представляет собой голубовато-серебристо-белый металл, податливый и податливый. Он хорошо проводит тепло и электричество.
Алюминий — трехвалентный элемент со степенью окисления +3 (очень редко +1 и +2). Среди оксидов алюминия (алюминий, таллий, индий, галлий) проявляет наибольшую электроотрицательность и наибольшую химическую активность.На воздухе он покрывается тонким, но плотным и невидимым защитным слоем оксида алюминия, препятствующим дальнейшему окислению. При температуре 100 o С алюминий реагирует с водой, вытесняя из нее водород и образуя гидроксид алюминия:
\ (2Al + 3H_2O \ rightarrow 2Al(OH) _3 ↓ + 3 H_2 ↑ \).
\ (2Al + 2 NaOH + 6H_2O \ rightarrow 2Na [Al(OH)_4] + 3H_2 ↑ \).
Концентрированная серная кислота и разбавленная азотная кислота при горячем растворяют алюминий, но реакция не дает образования водорода, т.к. сера в степени окисления +6 и азот +5 восстанавливаются тогда легче, чем водород H + :\ (8 Al + 27HNO_3 \ rightarrow 8 Al(NO_3)_3 + 3 NH_3 + 9H_2O \).
\(3Fe_3O_4+4Al\стрелка вправо 4Al_2O_3+9Fe+811\:\text{ккал}\)).
Хлорид алюминия широко используется в органической химии в качестве катализатора в реакциях Фриделя и Крафтса, которые включают введение алкильной группы, полученной из галоалкильного соединения, в бензольное кольцо.
Сульфат алюминия используется при крашении и изготовлении бумаги, а калийно-алюминиевые квасцы используются для дубления кожи, в качестве протравы для окрашивания тканей, очистки воды. В косметике используется как вяжущее средство (для бритья), а в медицине как противоядие при отравлении солями свинца.
Соединения алюминия
Соли алюминиевых и кислородных минеральных кислот
Алюминиевый сульфат AL 2 (SO 4 ) 3 18 H 40151 40151. гидроксид алюминия, а также бокситы или глины. Эта соль подвергается гидролизу в водных растворах. Если в водном растворе, кроме сульфата алюминия, есть еще сульфаты щелочи или аммония, то из раствора кристаллизуется двойная соль, называемая квасцами.{II}(SO_4)_3\cdot 24H_2O\). Наиболее известный представитель этой группы – алюмокалиевые квасцы К 2 СО 4 · Ал 2 (СО 4 ) 3 90 152 · 24 Н 2 О.
.Температура плавления металлов, которая колеблется от низшей (-39°С для ртути) до высшей (3400°С для вольфрама), а также плотность твердых металлов при 20°С и плотность жидких металлов при температуры плавления приведены в таблице плавки цветных металлов .
Таблица 1. Выплавка цветных металлов
| Атомный вес | Температура плавления t и , °С | Плотность ρ , г/см3 | ||
| устойчивый при 20°С | редко в т и | |||
| Алюминий | ||||
| Вольфрам | ||||
| Марганец | ||||
| молибден | ||||
| Циркон | ||||
Сварка меди .Температура плавления металлической Cu почти в шесть раз выше температуры плавления стали, медь интенсивно поглощает и растворяет различные газы, образуя с кислородом оксиды. Оксид меди II с медью образует эвтектику, температура плавления которой (1064 °С) ниже, чем у меди (1083 °С). Когда жидкая медь затвердевает, эвтектика располагается по границам зерен, что делает медь хрупкой и склонной к растрескиванию. Поэтому основной задачей при сварке меди является защита ее от окисления и активное раскисление сварочной ванны.
Наиболее распространена газовая сварка меди кислородно-ацетиленовым пламенем с использованием горелок в 1,5...2 раза мощнее стальной сварочной горелки. Связующее — медные стержни, содержащие фосфор и кремний. Если толщина изделий больше 5...6 мм, их сначала нагревают до температуры 250...300°С. Сварочные флюсы представляют собой обожженную буру или смесь 70 % буры и 30 % борной кислоты. Повышают механические свойства и улучшают структуру наплавленного металла, медь после сварки проковывают при температуре ок.200...300°С. Затем его повторно нагревают до 500-550°С и охлаждают в воде. Медь также сваривают электродугой с электродами, в токе защитных газов, под слоем флюса, на конденсаторных машинах методом трения.
сварка латуни . Латунь представляет собой сплав меди и цинка (до 50%). Основным загрязнением в этом случае является испарение цинка, в результате чего шов теряет свои свойства, в нем появляются поры.Латунь, как и медь, в основном сваривают ацетиленовым окислительным пламенем, которое образует на поверхности ванны пленку тугоплавкого оксида цинка, ограничивающую дальнейшее прогорание и испарение цинка. Флюсы используются так же, как и для сварки меди. Они образуют на поверхности ванны шлаки, которые связывают оксиды цинка и затрудняют выход паров из сварочной ванны. Латунь также сваривают в защитных газах и на контактных машинах.
бронзовая сварка .В большинстве случаев бронза является литейным материалом, поэтому сварка
применяется при устранении дефектов или при ремонте. Наиболее часто используется сварка металлическим электродом. Связующее изготавливается из стержней того же состава, что и основной металл, а флюсы или покрытие электродов представляют собой соединения хлоридов и фторидов калия и натрия.
. Основными факторами, препятствующими сварке алюминия, являются его низкая температура плавления (658°С), высокая теплопроводность (примерно в 3 раза выше теплопроводности стали), образование тугоплавких оксидов алюминия, имеющих температуру плавления 2050°С. С, т.е. технология плавки цветных металлов , , такие как медь или бронза, не подходят для плавки алюминия.Кроме того, эти оксиды плохо реагируют как с кислотными, так и с основными флюсами и поэтому плохо удаляются из сварного шва.
Самый распространенный факел для газовой сварки алюминия с ацетиленом. В последние годы получили широкое распространение также сварка под флюсом и автоматическая дуговая сварка металлическими электродами в среде аргона. Для всех способов сварки, за исключением аргонодуговой, применяют флюсы или электродные покрытия, в состав которых входят соединения фтора и хлора, лития, калия, натрия и других элементов.Проволока или стержни того же состава, что и основной металл, используются в качестве связующего для всех способов сварки.
Алюминий хорошо сваривается электронным лучом в вакууме, на контактных машинах, электрошлаковым и другими способами.
Сварка алюминиевых сплавов . Алюминиевые сплавы с магнием и цинком свариваются без особых осложнений
, так же как и алюминий. Исключение составляет дюралюминий – алюминиево-медные сплавы.Эти сплавы термически упрочняются после закалки и последующего старения. При температуре плавления цветных металлов выше 350°С в них происходит снижение прочности, не восстанавливаемое термической обработкой. Поэтому при сварке дюралюминия в околошовной зоне прочность падает на 40...50 %. Если дюраль сваривают в защитных газах, то такое снижение можно восстановить термической обработкой до 80...90 % по отношению к прочности основного металла.
Сварка магниевых сплавов . При газовой сварке обязательно применяют фторидные флюсы, которые в отличие от хлоридных флюсов не вызывают коррозии сварных соединений. Дуговая сварка магниевых сплавов металлическими электродами из-за низкого качества сварных швов до сих пор не применялась. При сварке магниевых сплавов наблюдается значительное увеличение зерна на участках, близких к шву, и сильное развитие столбчатых кристаллов в шве.Поэтому предел прочности сварных соединений составляет 55...60 % предела прочности основного металла.
Таблица 2. Физические свойства промышленных цветных металлов
| Недвижимость | М м и высокий | |||||||||||
| Атомный номер | ||||||||||||
| Атомный вес | ||||||||||||
| при температуре 20°С, кг/м² 3 | ||||||||||||
| Температура плавления, °С | ||||||||||||
| Температура кипения, °С | ||||||||||||
| Атомный диаметр, нм | ||||||||||||
| Скрытая теплота плавления, кДж/кг | ||||||||||||
| Скрытая теплота парообразования | ||||||||||||
| Удельная теплоемкость при температуре 20°С, Дж/(кг .°С) | ||||||||||||
| Удельная теплопроводность, 20°С, Вт/(м - °С) | ||||||||||||
| Коэффициент линейного расширения при температуре 25°С, 10 6 - ° З - 1 | ||||||||||||
| Удельное электрическое сопротивление при температуре 20°С, мкОм - м | ||||||||||||
| Модуль нормальной упругости, ГПа | ||||||||||||
| Модуль сдвига, ГПа | ||||||||||||
Неотъемлемой частью производства металла и металлических изделий является их использование в процессе производства тиглей для производства, плавки и переплава черных и цветных металлов.Тигли являются составной частью металлургического оборудования для литья различных металлов, сплавов и тому подобного.
Керамический тигель для плавки цветных металлов используется для плавки металлов (медь, бронза) с древних времен.
После кристаллизации убедитесь, что вещество достаточно чистое. Наиболее простым и эффективным методом выявления и определения меры чистоты вещества является определение его температуры плавления ( Т пл). Температура плавления – это диапазон температур, при котором твердое вещество становится жидким.Все чистые химические вещества имеют узкий температурный диапазон перехода из твердого состояния в жидкое. Этот диапазон температур для чистых веществ составляет максимум 1-2 o C. Использование температуры плавления в качестве меры чистоты вещества основано на том, что наличие примесей (1) снижает температуру плавления и ( 2) расширяет диапазон температур плавления. Например, чистый образец бензойной кислоты плавится в интервале 120-122°С, а слабозагрязненный образец плавится при 114-119°С.
Использование точки плавления для идентификации, конечно, сопряжено с большой неопределенностью, поскольку существует несколько миллионов органических соединений, и многие из них неизбежно совпадают с их точками плавления. Однако, во-первых, Т т.пл. вещества, полученного в синтезе, почти всегда отличается от Т т.пл. исходных соединений. Во-вторых, можно использовать технику «задания температуры плавления смешанного образца». Если Т пл смеси равных количеств испытуемого вещества и известного образца не отличаются от Т пл последнего, то оба образца представляют собой одно и то же вещество.
МЕТОД ОПРЕДЕЛЕНИЯ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ . Тщательно растереть испытуемое вещество в мелкий порошок. Капилляр заполняют веществом (высотой 3-5 мм; капилляр должен быть тонкостенным, запаянным с одной стороны, внутренним диаметром 0,8-1 мм и высотой 3-4 см). Для этого осторожно вдавливают открытый конец капилляра в порошок вещества и периодически постукивают его запаянным концом о поверхность стола 5-10 раз. Для полного вытеснения порошка к запаянному концу капилляра его насыпают в вертикальную стеклянную трубку (длиной 30-40 см и диаметром 0,5-1 см) на твердой поверхности.Вставьте капилляр в металлический патрон, прикрепленный к наконечнику термометра (рис. 3.5), и поместите термометр с патроном в прибор для определения температуры плавления.
В приборе термометр с капиллярами нагревается электрической катушкой, напряжение на которую подается через трансформатор, а скорость нагрева зависит от приложенного напряжения. Сначала аппарат нагревают со скоростью 4-6°С в минуту и на 10°С, а затем ожидаемый Т пл нагревают со скоростью 1-2°С в минуту.За температуру плавления принимают расстояние от размягчения кристаллов (смачивания вещества) до полного их плавления.
Полученные данные заносятся в лабораторный журнал.
Дистилляция является важным и широко используемым методом очистки органических жидкостей и разделения жидких смесей. Этот метод включает кипячение и испарение жидкости, а затем конденсацию паров в дистиллят. Разделение двух жидкостей с разницей температур кипения 50-70°С и более можно осуществить простой перегонкой.Если разница меньше, необходимо применять фракционную перегонку в более сложном аппарате. Некоторые жидкости с высокой температурой кипения разлагаются при перегонке. Однако при падении давления температура кипения падает, что позволяет перегонять высококипящие жидкости без разложения в вакууме.
При котором кристаллическая решетка металла разрушается и переходит из твердого состояния в жидкое.
Температура плавления металлов - показатель температуры нагретого металла, при которой начинается процесс (плавление).Сам процесс противоположен кристаллизации и неразрывно с ней связан. Расплавить металл? Он должен быть нагрет внешним источником, нагрет до точки плавления, а затем продолжать обеспечивать тепло для преодоления энергии фазового перехода. Дело в том, что значение температуры плавления металлов само по себе указывает на температуру, при которой материал будет находиться в фазовом равновесии на границе жидкость-твердое тело. При этой температуре чистый металл может находиться как в твердом, так и в жидком состоянии одновременно.Для осуществления процесса плавления необходимо перегреть металл немного выше равновесной температуры, чтобы обеспечить положительный термодинамический потенциал. Усильте процесс.
Температура плавления металлов постоянна только для чистых веществ. Наличие примесей будет смещать равновесный потенциал в ту или иную сторону. Это связано с тем, что металл с примесями образует другую кристаллическую решетку, и силы взаимодействия атомов в них будут отличаться от таковых в чистых материалах.В зависимости от температуры плавления металлы делят на легкоплавкие (до 600°С, например галлий, ртуть), среднеплавкие (600-1600°С, медь, алюминий) и тугоплавкие (>1600°С, вольфрам, молибден).
В современном мире чистые металлы редко используются из-за их ограниченных физических свойств. В промышленности давно и плотно используются различные сочетания металлов - сплавов, разновидностей и свойств которых гораздо больше. Температура плавления металлов, из которых состоят различные сплавы, также будет отличаться от точки плавления их сплава.Различные концентрации веществ определяют порядок их плавления или кристаллизации. Однако существуют равновесные концентрации, при которых металлы, входящие в состав сплава, затвердевают или плавятся одновременно, т. е. ведут себя как однородный материал. Такие сплавы называются эвтектическими.
Знание температуры плавления очень важно при работе с металлом, это значение необходимо как на производстве, для расчета параметров сплава, так и при эксплуатации металлических изделий, когда изменяется температура фазового перехода материала, из которого изготовлено изделие делается решает.ограничения в его использовании. Для удобства эти данные сведены в единую плавку металлов — суммарный результат физических характеристик различных металлов. Аналогичные таблицы есть и для сплавов. Температура плавления металлов также зависит от давления, поэтому данные в таблице приведены для конкретного значения давления (обычно это нормальные условия, когда давление составляет 101,325 кПа). Чем выше давление, тем выше температура плавления, и наоборот.
Одним из основных направлений в металлургической промышленности является литье металлов и их сплавов в связи с дешевизной и относительной простотой процесса.Вы можете отливать формы любого контура различных размеров, от маленьких до больших; подходит как для массового производства, так и для индивидуального производства.
Литье является одним из древнейших направлений металлообработки и берет свое начало примерно в бронзовом веке: 7-3 тысячелетия до н.э. мне. С тех пор было открыто много материалов, что привело к технологическому прогрессу и повышению требований в литейной промышленности.
В настоящее время существует множество направлений и видов литья, отличающихся технологическим процессом.Одно остается неизменным – физическое свойство металлов переходить из твердого состояния в жидкое, и важно знать, при какой температуре начинают плавиться разные виды металлов и их сплавов.
 Этот процесс относится к переходу вещества из твердого состояния в жидкое. После достижения температуры плавления металл может быть как твердым, так и жидким, дальнейший рост приведет к полному жидкостному переходу материала.
Этот процесс относится к переходу вещества из твердого состояния в жидкое. После достижения температуры плавления металл может быть как твердым, так и жидким, дальнейший рост приведет к полному жидкостному переходу материала.
То же самое происходит и при затвердевании - как только будет достигнута точка плавления, вещество начнет переходить из жидкого состояния в твердое, а температура не изменится до полной кристаллизации.
При этом следует помнить, что это правило распространяется только на голое железо. Сплавы не имеют четкого температурного предела и совершают переходы состояний в определенном диапазоне:
Точка плавления таких веществ не может быть точно измерена, точка перехода состояния указывает числовой диапазон.
В зависимости от температуры, при которой начинается плавление металлов, их принято делить на:
Существует также точка кипения - точка, при которой расплавленный металл начинает выделяться газом. Он очень теплый, обычно в 2 раза выше температуры плавления.
Температура плавления и равная ему температура замерзания зависят от давления, которое увеличивается с ростом давления.Это связано с тем, что при увеличении давления атомы сближаются друг с другом и должны быть отодвинуты, чтобы разрушить кристаллическую решетку. Для высокого кровяного давления требуется больше энергии теплового движения, и соответствующая температура плавления увеличивается.
Существуют исключения, когда температура, необходимая для сжижения, снижается с увеличением давления. К таким веществам относятся лед, висмут, германий и сурьма.
Для всех, кто работает в сталелитейной промышленности, будь то сварщик, литейщик, сталевар или ювелир, важно знать, при каких температурах плавятся материалы, с которыми они работают.В таблице ниже приведены температуры плавления наиболее распространенных веществ.
Таблица температур плавления металлов и сплавов
| Имя | Т.пл, °С |
|---|---|
| Алюминий | 660,4 |
| Медь | 1084,5 |
| Олово | 231,9 |
| Цинк | 419,5 |
| Вольфрам | 3420 |
| Никель | 1455 |
| Серебро | 960 |
| Золото | 1064,4 |
| Платина | 1768 |
| Титан | 1668 |
| Дюралюминий | 650 |
| Углеродистая сталь | 11:00-15:00 |
| 11:10-14:00 | |
| Железо | 1539 |
| Меркурий | -38.9 |
| Мельхиор | 1170 |
| Циркон | 3530 |
| Кремний | 1414 |
| Нихром | 1400 |
| Висмут | 271,4 |
| немецкий | 938,2 |
| банка | 13:00-15:00 |
| Коричневый | 930-1140 |
| Кобальт | 1494 |
| Калий | 63 |
| Натрий | 93,8 |
| Латунь | 1000 |
| Магний | 650 |
| Марганец | 1246 |
| Хром | 2130 |
| молибден | 2890 |
| Свинец | 327,4 |
| Берилл | 1287 |
| , чтобы выиграть | 3150 |
| Фехраль | 1460 |
| Сурьма | 630,6 |
| Карбид титана | 3150 |
| карбид циркония | 3530 |
| Гал | 29,76 |
Помимо плавильного стола есть много других вспомогательных материалов.Например, ответ на вопрос, какова температура кипения железа, дан в таблице кипящих веществ. Помимо кипения, металлы обладают рядом других физических свойств, таких как прочность.
Помимо возможности перехода из твердого состояния в жидкое, одним из важных свойств материала является его прочность - возможность твердого сопротивления растрескиванию и необратимым изменениям формы. Основным показателем прочности считается сопротивление, возникающее в результате разрушения предварительно отожженной заготовки.Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Прочность определяют в МПа - МегаПаскалях.
Группы прочности металла следующие:
Таблица прочности металла
Как видно из таблицы, температуры плавления элементов значительно различаются даже для материалов, распространенных в быту.
Ну и минимальная температура.У ртути температура плавления -38,9°С, так что она уже жидкая при комнатной температуре. Этим и объясняется тот факт, что бытовые термометры имеют более низкий показатель -39 градусов Цельсия: ниже этого показателя ртуть становится твердой.
Наиболее часто используемые в бытовом применении припои имеют значительный процент содержания олова, имеющего температуру плавления 231,9°С, поэтому большинство припоев плавятся при рабочей температуре паяльника 250-400°С.
Кроме того, существуют легкоплавкие припои с более низкой температурой плавления, до 30°С, и применяются, когда опасен перегрев припаиваемых материалов. Для этих целей применяют припой с висмутом, а плавление этих материалов находится в пределах 29,7 - 120°С.
Температура плавления высокоуглеродистых материалов колеблется от 1100 до 1500°С в зависимости от легирующих элементов.
Температуры плавления металлов и их сплавов лежат в очень широком диапазоне температур, от очень низких температур (ртутный) до нескольких тысяч градусов. Знание этих показателей, как и других физических свойств, очень важно для людей, работающих в металлургической промышленности. Например, знание температуры плавления золота и других металлов пригодится ювелирам, литейщикам и сталелитейщикам.
Каждый металл и сплав имеет свой уникальный набор физических и химических свойств, не последним из которых является температура плавления.Сам процесс означает переход тела из одного физического состояния в другое, в данном случае из кристаллического твердого состояния в жидкое. Чтобы расплавить металл, необходимо приложить к нему тепло, пока не будет достигнута температура плавления. При нем он еще может оставаться твердым, но при дальнейшем воздействии и повышении температуры металл начинает плавиться. Если температуру понизить, то есть отвести некоторое количество тепла, элемент затвердеет.
Самая высокая температура плавления среди металлов принадлежит вольфраму : она составляет 3422 °С, самая низкая - у ртути: элемент плавится при - 39 °С.Как правило, точное значение для сплавов определить не удается: оно может существенно варьироваться в зависимости от процентного содержания компонентов. Обычно они записываются в виде диапазона чисел.
Все металлы плавятся примерно одинаково - при внешнем или внутреннем нагреве. Первый проходит в термической печи, второй при переходе - нагрев электрическим сопротивлением или индукционный нагрев в высокочастотном электромагнитном поле.Оба варианта воздействуют на металл схожим образом.
С повышением температуры амплитуда тепловых колебаний молекул также увеличивается, появляются дефекты структурной сетки, которые выражаются в увеличении дислокаций, скачков атомов и других нарушений. Это сопровождается разрывом межатомных связей и требует определенного количества энергии. При этом на поверхности тела образуется квазижидкий слой. Период разрушения сети и накопления дефектов называется плавлением.
В зависимости от температуры плавления металлы делятся на:
В зависимости от температуры плавления выбирают и плавильный аппарат. Чем выше оценка, тем сильнее она должна быть. Вы можете проверить температуру необходимого элемента в таблице.
Другим важным значением является температура кипения. Это значение, при котором жидкость начинает кипеть, оно соответствует температуре насыщенного пара, образующегося над плоской поверхностью кипящей жидкости. Обычно она почти в два раза выше температуры плавления.
Оба значения обычно указываются при нормальном давлении. Между собой прямо пропорциональны .