Алюминий как атом и химический элемент
Алюминий находится в \(IIIA\) группе Периодической системы химических элементов Д. И. Менделеева.
Строение электронной оболочки атома алюминия — 1s22s22p63s23p1.
На внешнем электронном уровне атом содержит \(3\) электрона.
Поэтому в своих соединениях алюминий всегда проявляет только одну степень окисления, равную \(+3\).
Обрати внимание!
По распространённости в земной коре алюминий находится на третьем месте после кислорода и кремния, а среди металлов — на первом.
В земной коре алюминий встречается только в составе соединений.
Основные природные минералы алюминия:
Каолинит — образец многочисленных алюмосиликатов, включающих преимущественно атомы кремния и кислорода, которые очень широко распространены в природе.
Физические свойства
В свободном состоянии алюминий — светлый блестящий металл, лёгкий, относительно мягкий, легкоплавкий, имеет высокую тепло- и электропроводность.
Алюминий является химически активным металлом, однако при обычных условиях он устойчив на воздухе и сохраняет свой металлический блеск длительное время. Это объясняется тем, что поверхность алюминия покрыта тонкой, невидимой глазу, прозрачной, но плотной плёнкой оксида алюминия, которая препятствует взаимодействию алюминия с компонентами атмосферы (парами воды и кислородом).
Свойства алюминия обусловили его широкое применение и необходимость получения алюминия в свободном виде.
В лабораторных условиях небольшое количество алюминия можно получить путём восстановления хлорида алюминия калием при высокой температуре:
AlCl3+3K=t3KCl+Al.
Так был впервые получен алюминий.
В промышленных условиях алюминий получают из бокситов. При нагревании бокситов образуется оксид алюминия. Восстановить алюминий из оксида с помощью традиционных восстановителей практически невозможно, поэтому его получают методом электролиза.
При этом на катоде восстанавливается алюминий, а на аноде — окисляется кислород.
Суммарная реакция электролиза выражается уравнением:
2Al2O3=4Al+3O2↑.
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
В природе алюминий встречается в виде минералов:
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3[AlF6]). Галлий, индий и таллий получают схожим образом - методом электролиза их оксидов и солей.
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + O2 → Al2O3 (снаружи Al покрыт оксидной пленкой - Al2O3)
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)
Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι - двойственный), вступает в реакции как с кислотами, так и с основаниями.
Al + HCl → AlCl3 + H2
Al + H2SO 4(разб.) → Al2(SO4)3 + H2↑
Al + H2SO4(конц.) → (t) Al2(SO4)3 + SO2↑ + H2O
Al + HNO3(разб.) → (t) Al(NO3)3 + N2O + H2O
Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде - выделяется водород)
При прокаливании комплексные соли не образуются, так вода испаряется - вместо них образуются (в рамках ЕГЭ) средние соли - алюминаты (академически - сложные окиселы):
Na[Al(OH)4] → (t) NaAlO2 + H2O
При комнатной температуре не идет из-за образования оксидной пленки - Al2O3 - на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) - реакция идет.
Al + H2O → (t) Al(OH)3 + H2↑
Алюминотермия (лат. Aluminium + греч. therme - тепло) - способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.
Fe2O3 + Al → (t) Al2O3 + Fe
Cr2O3 + Al → (t) Al2O3 + Cr
MnO2 + Al → (t) Al2O3 + Mn
Оксид алюминия получают в ходе взаимодействия с кислородом - на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Al + O2 → Al2O3
Al(OH)3 → (t) Al2O3 + H2O↑
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + H2SO4 → Al2(SO4)3 + H2O
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Al2O3 + NaOH → (t) NaAlO2 + H2O (алюминат натрия)
Al2O3 + Na2O → (t) NaAlO2
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок - гидроксид алюминия.
AlBr3 + LiOH → Al(OH)3↓ + LiBr
Al(NO3)3 + K2CO3 → KNO3 + Al(OH)3↓ + CO2 (двойной гидролиз: Al(NO3)3 гидролизуется по катиону, K2CO3 - по аниону)
Al2S3 + H2O → Al(OH)3↓ + H2S↑
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание - Li3[Al(OH)6] - гексагидроксоалюминат лития)
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Здравствуй, уважаемый читатель! Сейчас мы будем разбираться с таким интереснейшим элементом, как алюминий, и подробно узнаем о его свойствах.
Алюминий является самым распространенным металлом, находящимся в соединениях в составе земной коры, следом за ним идёт железо. Но несмотря на этот факт, алюминий — не самый дешёвый в производстве металл (самый дешёвый — свинец) и на его получение тратится значительно больше энергии, чем на производство железа. Немного позже вы узнаете почему.
Алюминий — уникальный металл в том смысле, что изготавливать из него можно почти всё что угодно: фольгу, банки для напитков, кружки, ложки, крючки для одежды — он необычайно ковкий. Однако, из-за этой ковкости его трудно использовать в несущих деталях конструкций, например арматуры или газовых баллонов, для изготовления которых используются более твёрдые материалы.
Алюминиевая коллекционная монетаЧтобы узнать, как можно получать алюминий, нужно узнать о том, в каком виде он встречается в природе.
Самый распространенный минерал алюминия — это его оксид Al2O3. В природе он встречается в разных минералах, из которых самый распространённый — боксит Al2O3 * xH2O:
БокситВключения других элементов в состав минерала делают его необычайно красивым. Прекрасные рубин, сапфир, топаз, аквамарин представляют из себя минералы, состоящие в основном из оксида алюминия, цвет которых обеспечивается за счет примесей — соединений хрома(II и III), железа, титана, марганца и многих других.
 Рубин
Рубин Сапфир
Сапфир Топаз
Топаз Озеро близ города Кыштым (Челябинская область), цвет которого вызван наличием каолиновой глины, в состав которой входит алюминий
Озеро близ города Кыштым (Челябинская область), цвет которого вызван наличием каолиновой глины, в состав которой входит алюминийВместе с кремнием алюминий образует группу самых распространённых в земной коре минералов. Их объединяют под общим названием — алюмосиликаты, подчёркивая наличие алюминия и кремния (silicium) в их составе.
АквамаринКак мы уже выяснили, всё или почти всё, что из себя представляет природный алюминий, — это его оксид Al2O3. Алюминий — очень активный металл, поэтому его извлечь из оксида непросто. Приведём некоторые цифры: энергия Гиббса сродства к кислороду, то есть образования оксида, составляет около -300 кДж/моль! А электродный потенциал реакции восстановления алюминия(3+) составляет -1,7 В, что ставит его рядом с бериллием и марганцем.
Поэтому одним из самых распространённых способов для его получения служит электролиз расплава.
Сам оксид алюминия (корунд) чрезвычайно тугоплавкий, поэтому к нему добавляют гексафторалюминат натрия — природный минерал криолит.
КриолитОн имеет формулу Na3[AlF6] — это комплексное соединение, которое можно получить из водного оксида алюминия по следующей реакции:
\(2Al(OH)_3 + 3Na_2CO_3 + 18HF = 2Na_3[AlF_6] + 3CO_2\uparrow + 9H_2O\)На территории России криолит встречается в непригодном для получения алюминия виде (загрязнённом), поэтому для электролиза расплава его получают по вышеприведённой реакции.
Вместе с ним к оксиду алюминия добавляют также фторид кальция CaF2, и в результате смесь начинает плавиться при 950оС.
В расплавленную смесь погружают графитовые электроды и создают напряжение, в результате чего происходит процесс электролиза, который в данном случае точно описать довольно сложно, поэтому ограничимся приблизительными реакциями.
\(Al_2O_3 = AlO^+ + AlO_2^-\) \(\quad \ominus 3AlO^+ + 3\overline{e} = Al\downarrow + Al_2O_3\) \(\quad \oplus 2AlO_2^- — 2\overline{e} = [O] + Al_2O_3\)Вместе с этим графитовые электроды довольно быстро сгорают при такой высокой температуре и количестве кислорода, который выделяется на них:
\(C + O_2 = CO_2\uparrow\)Суммируя всё вышесказанное, в процессе электролиза расплава на катоде выделяется алюминий, который из-за большей, нежели расплав, плотности собирается на дне жидким слоем; на аноде же выделяется кислород. Выглядит это вживую вот так:
Ванна электролиза расплаваКак мы уже сказали, алюминий — активный металл. Настолько активный, что может применяться как восстановитель железа, марганца, хрома и других подобных металлов, при этом переходя в очень стабильный оксид. Данный метод получения других металлов из их оксидов реакцией с алюминиевой пудрой носит название алюмотермия, или реакция термит:
\(3Fe_3O_4 + 8Al = 4Al_2O_3 + 9Fe\) \(3MnO_2 + 4Al = 3Mn + 2Al_2O_3\) \(Cr_2O_3 + 2Al = 2Cr + Al_2O_3\) ТермитКак вы уже заметили, в своём оксиде алюминий находится в степени окисления +3. И да, действительно, это самая устойчивая для алюминия степень окисления. Однако для него существует ещё одна ненулевая степень окисления! И это +1, о которой мы поговорим чуть позже.
Для начала отметим реакции алюминия со многими простыми веществами (при нагревании), элементы которых окружают алюминий в таблице Менделеева:
\(4Al + 3C = Al_4C_3 \quad \text{t = }1500^oC\) \(2Al + N_2 = 2AlN \quad t > 800^oC\) \(2Al + 3S = Al_2S_3 \quad t > 700^oC\)Многие из образующихся в подобных реакциях соединения легко гидролизуются:
\(Al_2S_3 + 6H_2O = 3H_2S\uparrow + 2Al(OH)_3\downarrow, \text{быстро}\) \(AlN + 4HCl = AlCl_3 + NH_4Cl, \text{медленно}\)Алюминий не реагирует с концентрированными азотной и серной кислотами — то есть пассивируется.
Однако с разбавленными кислотами-неокислителями (то есть разбавленной серной, соляной) реагирует с умеренной скоростью из-за довольно инертной плёнки оксида на поверхности, которая медленно «съедается» кислотой:
\(2Al + 6HCl = 2AlCl_3 + 3H_2\uparrow\)Гидроксид алюминия очень легко взаимодействует с кислотами, образуя соли алюминия:
\(Al(OH)_3 + 3HCl = AlCl_3 + 3H_2O\)Алюминий — амфотерный металл. Это значит, что он и его соединения проявляют как кислотные, так и основные свойства.
Например, он реагирует с раствором щелочи:
\(2Al + 2NaOH + 6H_2O = 2Na[Al(OH)_4] + 3H_2\uparrow\)Экспериментально замечено, что эта реакция идет с большей скоростью, нежели алюминия с кислотой, а значит мы можем сделать вывод, что кислотные свойства алюминия выражены сильнее, чем основные.
Помимо реакции с кислотой, гидроксид алюминия также легко растворяется и в растворе щёлочи!
\(Al(OH)_3 + NaOH = Na[Al(OH)_4]\)В результате этих реакций образуется комплексное соединение — тетрагидроксоалюминат натрия, которое имеет переменный состав, сильно зависящий от pH. В водных растворах при pH 13-14 (сильнощелочных средах) существуют тетрагидроксоалюминат-ионы, а при понижении pH (подкислении среды) между ионами начинают происходить процессы полимеризации через кислородные мостики. Например, охарактеризовано существование и строение ионов следующих составов:
\([Al_{13}O_4(OH)_{24}(H_2O)_{12}]^{7+},\quad [Al_{13}(OH)_{35}]^{4+}\)А вместе с однозарядными катионами (катионами щелочных металлов и аммония) образует устойчивые кристаллизующиеся соединения квасцы (название происходит от слова кислый, так как соединения алюминия гидролизуются и растворы солей имеют кислую реакцию среды):
\((NH_4)_2SO_4 + Al_2(SO_4)_3 + 24H_2O = 2NH_4Al(SO_4)_2 * 12H_2O\)В их структуре присутствуют тетраэдрические гексаакваионы [Al(H2O)6]3+.
Прекрасные кристаллы алюмокалиевых квасцовПри сплавлении со щелочами алюминий образует соль мета- или ортоалюминиевой кислоты. При этом также могут образоваться алюминаты более сложного состава:
\(Al(OH)_3 + NaOH = NaAlO_2 + 2H_2O\) \(NaAlO_2 + Na_2O = Na_3AlO_3\)Говоря о неустойчивых соединениях алюминия, начнём с гидрида. Обменной реакцией алан (гидрид алюминия) может быть получен в эфирном растворе:
\(3LiH + AlCl_3 = 3LiCl + AlH_3\downarrow\)Продукт этой реакции — твёрдое белое полимерное вещество. Структурные фрагменты [Al2H6] напоминают бораны, и из эфирных растворов может осаждаться также сольват AlH3 * xEt2O.
Выше 150оС алан разлагается на простые вещества:
\(2AlH_3 = 2Al + 3H_2\uparrow\)Вот мы и дошли до места, где упомянем соединения алюминия в степени окисления +1. Да, они немногочисленны, но сказать о них стоит.
Выше 1000 градусов Цельсия существует оксид Al2O, получаемый реакцией обычного оксида с кремнием:
\(Al_2O_3 + 2Si = Al_2O\uparrow + 2SiO\)А при нагревании фторида алюминия(III) с металлическим алюминием образуется субфторид алюминия — синий газ:
\(AlF_3 + 2Al = 3AlF\uparrow\)Так как подобные соединения являются летучими и легко разлагаются, их можно использовать в транспортных реакциях для очистки алюминия. Это такие реакции, где в одной части прибора из грязного источника получается летучий оксид или субфторид, а в другой части прибора, скажем, на раскалённой проволоке, этот неустойчивый газ разлагается, образуя высокочистый алюминий.
Также известен сульфид:
\(Al_2S_3 + 4Al = 3Al_2S\)Эти соединения необходимо получать в инертной атмосфере.
Любите химию!
Все года изданияТекущий годПоследние 2 годаПоследние 5 летПоследние 10 лет
Все виды изданийУчебная литератураНаучная литератураЖурналыМатериалы конференций
Все темыЕстественные и точные наукиАстрономияБиологияГеографияГеодезия. КартографияГеологияГеофизикаИнформатикаКибернетикаМатематикаМеханикаОхрана окружающей среды. Экология человекаФизикаХимияТехнические и прикладные науки, отрасли производстваАвтоматика. Вычислительная техникаБиотехнологияВодное хозяйствоГорное делоЖилищно-коммунальное хозяйство. Домоводство. Бытовое обслуживаниеКосмические исследованияЛегкая промышленностьЛесная и деревообрабатывающая промышленностьМашиностроениеМедицина и здравоохранениеМеталлургияМетрологияОхрана трудаПатентное дело. Изобретательство. РационализаторствоПищевая промышленностьПолиграфия. Репрография. ФотокинотехникаПриборостроениеПрочие отрасли экономикиРыбное хозяйство. АквакультураСвязьСельское и лесное хозяйствоСтандартизацияСтатистикаСтроительство. АрхитектураТранспортХимическая технология. Химическая промышленностьЭлектроника. РадиотехникаЭлектротехникаЭнергетикаЯдерная техникаОбщественные и гуманитарные наукиВнешняя торговляВнутренняя торговля. Туристско-экскурсионное обслуживаниеВоенное делоГосударство и право. Юридические наукиДемографияИскусство. ИскусствоведениеИстория. Исторические наукиКомплексное изучение отдельных стран и регионовКультура. КультурологияЛитература. Литературоведение. Устное народное творчествоМассовая коммуникация. Журналистика. Средства массовой информацииНародное образование. ПедагогикаНауковедениеОрганизация и управлениеПолитика и политические наукиПсихологияРелигия. АтеизмСоциологияФизическая культура и спортФилософияЭкономика и экономические наукиЯзыкознаниеХудожественная литератураХудожественные произведения
Все институтыВоенно-инженерный институтБазовая кафедра специальных радиотехнических системВоенная кафедраУчебно-военный центрГуманитарный институтКафедра ИТ в креативных и культурных индустрияхКафедра истории России, мировых и региональных цивилизацийКафедра культурологии и искусствоведенияКафедра рекламы и социально-культурной деятельностиКафедра философииЖелезногорский филиал СФУИнженерно-строительный институтКафедра автомобильных дорог и городских сооруженийКафедра инженерных систем, зданий и сооруженийКафедра проектирования зданий и экспертизы недвижимостиКафедра строительных конструкций и управляемых системКафедра строительных материалов и технологий строительстваИнститут архитектуры и дизайнаКафедра архитектурного проектированияКафедра градостроительстваКафедра дизайнаКафедра дизайна архитектурной средыКафедра изобразительного искусства и компьютерной графикиИнститут горного дела, геологии и геотехнологийКафедра геологии месторождений и методики разведкиКафедра геологии, минералогии и петрографииКафедра горных машин и комплексовКафедра инженерной графикиКафедра маркшейдерского делаКафедра открытых горных работКафедра подземной разработки месторожденийКафедра технической механикиКафедра технологии и техники разведкиКафедра шахтного и подземного строительстваКафедра электрификации горно-металлургического производстваИнститут инженерной физики и радиоэлектроникиБазовая кафедра "Радиоэлектронная техника информационных систем"Базовая кафедра инфокоммуникацийБазовая кафедра физики конденсированного состояния веществаБазовая кафедра фотоники и лазерных технологийКафедра нанофазных материалов и нанотехнологийКафедра общей физикиКафедра приборостроения и наноэлектроникиКафедра радиотехникиКафедра радиоэлектронных системКафедра современного естествознанияКафедра теоретической физики и волновых явленийКафедра теплофизикиКафедра экспериментальной физики и инновационных технологийКафедры физикиИнститут космических и информационных технологийБазовая кафедра "Интеллектуальные системы управления"Базовая кафедра "Информационные технологии на радиоэлектронном производстве"Базовая кафедра геоинформационных системКафедра высокопроизводительных вычисленийКафедра вычислительной техникиКафедра информатикиКафедра информационных системКафедра прикладной математики и компьютерной безопасностиКафедра разговорного иностранного языкаКафедра систем автоматики, автоматизированного управления и проектированияКафедра систем искусственного интеллектаИнститут математики и фундаментальной информатикиБазовая кафедра вычислительных и информационных технологийБазовая кафедра математического моделирования и процессов управленияКафедра алгебры и математической логикиКафедра высшей и прикладной математикиКафедра математического анализа и дифференциальных уравненийКафедра математического обеспечения дискретных устройств и системКафедры высшей математики №2афедра теории функцийИнститут нефти и газаБазовая кафедра пожарной и промышленной безопасностиБазовая кафедра проектирования объектов нефтегазового комплексаБазовая кафедра химии и технологии природных энергоносителей и углеродных материаловКафедра авиационных горюче-смазочных материаловКафедра бурения нефтяных и газовых скважинКафедра геологии нефти и газаКафедра геофизикиКафедра машин и оборудования нефтяных и газовых промысловКафедра разработки и эксплуатации нефтяных и газовых месторожденийКафедра технологических машин и оборудования нефтегазового комплексаКафедра топливообеспеченя и горюче-смазочных материаловИнститут педагогики, психологии и социологииКафедра информационных технологий обучения и непрерывного образованияКафедра общей и социальной педагогикиКафедра психологии развития и консультированияКафедра современных образовательных технологийКафедра социологииИнститут торговли и сферы услугБазовая кафедра таможенного делаКафедра бухгалтерского учета, анализа и аудитаКафедра гостиничного делаКафедра математических методов и информационных технологий в торговле и сфере услугКафедра технологии и организации общественного питанияКафедра товароведения и экспертизы товаровКафедра торгового дела и маркетингаОтделение среднего профессионального образования (ОСПО)Институт управления бизнес-процессамиКафедра бизнес-информатики и моделирования бизнес-процессовКафедра маркетинга и международного администрированияКафедра менеджмент производственных и социальных технологийКафедра цифровых технологий управленияКафедра экономики и управления бизнес-процессамиКафедра экономической и финансовой безопасностиИнститут физ.культуры, спорта и туризмаКафедра медико-биологических основ физической культуры и оздоровительных технологийКафедра теоретических основ и менеджмента физической культуры и туризмаКафедра теории и методики спортивных дисциплинКафедра физической культурыИнститут филологии и языковой коммуникацииКафедра восточных языковКафедра журналистики и литературоведенияКафедра иностранных языков для гуманитарных направленийКафедра иностранных языков для естественнонаучных направленийКафедра иностранных языков для инженерных направленийКафедра романских языков и прикладной лингвистикиКафедра русского языка и речевой коммуникацииКафедра русского языка как иностранногоКафедра теории германских языков и межкультурной коммуникацииИнститут фундаментальной биологии и биотехнологииБазовая кафедра "Медико-биологические системы и комплексы"Базовая кафедра биотехнологииКафедра биофизикиКафедра водных и наземных экосистемКафедра геномики и биоинформатикиКафедра медицинской биологииИнститут цветных металлов и материаловеденияБазовая кафедра "Технологии золотосодержащих руд"Кафедра автоматизации производственных процессов в металлургииКафедра аналитической и органической химииКафедра инженерного бакалавриата СDIOКафедра композиционных материалов и физико-химии металлургических процессовКафедра литейного производстваКафедра металловедения и термической обработки металловКафедра металлургии цветных металловКафедра обогащения полезных ископаемыхКафедра обработки металлов давлениемКафедра общаей металлургииКафедра техносферной безопасности горного и металлургического производстваКафедра физической и неорганической химииКафедра фундаментального естественнонаучного образованияИнститут экологии и географииКафедра географииКафедра охотничьего ресурсоведения и заповедного делаКафедра экологии и природопользованияИнститут экономики, государственного управления и финансовБазовая кафедра цифровых финансовых технологий Сбербанка РоссииКафедра бухгалтерского учета и статистикиКафедра международной и управленческой экономикиКафедра социально-экономического планированияКафедра теоретической экономикиКафедра управления человеческими ресурсамиКафедра финансов и управления рискамиКрасноярская государственная архитектурно-строительная академияКрасноярский государственный технический университетКрасноярский государственный университетМежинститутские базовые кафедрыМежинститутская базовая кафедра "Прикладная физика и космические технологии"Политехнический институтБазовая кафедра высшей школы автомобильного сервисаКафедра конструкторско-технологического обеспечения машиностроительных производствКафедра материаловедения и технологии обработки материаловКафедра машиностроенияКафедра прикладной механикиКафедра робототехники и технической кибернетикиКафедра стандартизации, метрологии и управления качествомКафедра тепловых электрических станцийКафедра теплотехники и гидрогазодинамикиКафедра техногенных и экологических рисков в техносфереКафедра техносферной и экологической безопасностиКафедра транспортаКафедра транспортных и технологических машинКафедра химииКафедра электротехникиКафедра электроэнергетикиХакасский технический иститутЮридический институтКафедра гражданского праваКафедра иностранного права и сравнительного правоведенияКафедра конституционного, административного и муниципального праваКафедра международного праваКафедра предпринимательского, конкурентного и финансового праваКафедра теории и истории государства и праваКафедра теории и методики социальной работыКафедра трудового и экологического праваКафедра уголовного праваКафедра уголовного процеса и криминалистики
По релевантностиСначала новыеСначала старыеПо дате поступленияПо названиюПо автору
Цель урока
Задачи урока:
Оборудование и реактивы: карточки с текстами, презентация к уроку, видеоматериал, компьютер, экран, проектор, гранулы алюминия, р-р гидроксида натрия.
Наборы реактивов на столах учащихся: алюминиевая проволока, фольга, гранулы алюминия, растворы соляной кислоты и сульфата меди (2), спички, спиртовка, держатель, смайлики.
Раздаточный материал: карточки с текстом теста (2 варианта), с дифференцированным домашним заданием (д/з).
Ход урока
1. Организационный момент.
2. Изучение нового материала.
- Мы продолжаем изучать металлы, а какой металл мы будем изучать сегодня, предстоит определить вам. Итак, эпиграф к нашему уроку:
Я металл, серебристый и лёгкий
И зовусь “самолётный металл”,
И покрыт я оксидною плёнкой,
Чтоб меня кислород не достал... (слайд 2).
- Что же за металл мы сегодня будем изучать?
- Совершенно верно алюминий. И тема нашего урока “Алюминий: физические и химические свойства.. Применение алюминия” (слайд 3). Запишем тему урока в тетрадях.
- Давайте, вместе с вами, определим задачи урока (коллективное обсуждение)
- Итак, задачи нашего урока (слайд 4).
Изучение нового материала с актуализацией опорных знаний.
Характеристика алюминия как химического элемента.
Самостоятельная работа (слайд 5).
Проверка самостоятельной работы у доски.
Примерный ответ: Al №13. заряд ядра+13, протонов 13, нейтронов 14, электронов 13.
(слайд 6)
- Как изменяется химическая активность у этих химических элементов? (Выводы делают учащиеся).
Тип и класс: Al p – элемент, переходный элемент, соединения которого обладают амфотерными свойствами.
Тип химической связи - металлическая.
Тип кристаллической решетки - металлическая (вспоминаем физические свойства веществ с металлической химической связью).
- Сейчас я вам расскажу об истории открытия алюминия (рассказ).
Нахождение алюминия в природе (слайд 7).
- Основные месторождения алюминиевого сырья: Урал, Казахстан, Сибирь, Башкирстан.
Вопрос. Почему алюминия нет в природе в свободном виде?
- На основании справочных данных, учебника, эпиграфа к уроку и образцов алюминия на ваших столах охарактеризуйте физические свойства алюминия.
Ответы учащихся. (слайд 8 и образцы в лотках).
- На физико-механических свойствах основано его применение. (обсуждение)
Задание. Посмотрите слайды (9-15) и назовите области применения алюминия и свойства, на которых основано их применение (обсуждение).
Почему, очень часто, изделия изготавливаются из сплавов алюминия?
- Алюминий - активный металл, в чём же причина его пассивности? На этот вопрос мы ответим, посмотрев видео (видео 1).
Обсуждение результатов просмотра.
Ответ – на поверхности алюминия образуется пассивная оксидная плёнка.
Подвергаются ли коррозии изделия из алюминия? Почему?
Вывод: оксидная плёнка защищает алюминий от коррозии.
Влияние алюминия и изделий из него на здоровье человека (рассказ).
- При мытье алюминиевой посуды (внутри) можно использовать абразивные материалы? Ответ поясните.
С помощью лабораторных опытов изучим некоторые химические свойства алюминия
Видео 2 размещено в архиве вместе с презентацией.
- Алюминий взаимодействует с неметаллами.
- Запишите уравнения химических реакций алюминия с кислородом, серой и хлором. Укажите восстановитель и окислитель. К одному из уравнений напишите электронный баланс (по желанию). Ребята работают в тетрадях, проверяем у доски.
- Согласно ряду активности металлов алюминий должен реагировать с кислотами. Ставим проблему и решаем её с помощью лабораторных опытов.
Выполнение учащимися лабораторного опыта взаимодействие алюминия с соляной кислотой. Учащиеся записывают уравнение химической реакции на доске и в тетрадях.
Запомните - алюминий не реагирует с концентрированной азотной кислотой!
При взаимодействии с концентрированной серной кислотой водород не выделяется, а оксид серы (4) в основном.
Взаимодействие с гидроксидом натрия (демонстрация, запись уравнения химической реакции).
Вывод: алюминий проявляет амфотерные свойства.
- А почему?
- Так как реагирует и с кислотами и с основаниями. (Записать в тетради)
(слайд 16).
- Алюминий реагирует с некоторыми солями (выполнение учащимися лабораторного опыта взаимодействия алюминия с раствором сульфата меди (2)).
- ? Почему восстанавливается чистая медь из её соли?( уравнение д/з).
- Вывод делают учащиеся: согласно ряду напряжения металлов алюминий вытесняет менее активные металлы из их солей.
- Алюминий может восстанавливать некоторые металлы из их оксидов (например,из Fe2O3) (просмотр видео 3. Видео 3 размещено в архиве вместе с презентацией).
- Уравнение химической реакции запишите в д/з.
3. Закрепление изученного материала.
Выполнение теста.
1 вариант
1. Количество протонов в атоме алюминия:
А) 12,
В) 13,
С) 10,
D) 14.
2.Электронная формула иона алюминия - А1+3:
А) 1s22s22p6.
B) 1s22s22p63s2.
C) 1s22s22p63s1.
D) 1s22s22p63s2p1.
3. Алюминий менее активен, чем:
А) углерод,
B) натрий,
С) кремний,
D) фосфор.
4. Тип кристаллической решетки у алюминия:
А) ионная,
В) металлическая,
С) атомная,
D) молекулярная.
5. На каком физическом свойстве алюминия основано применение сплавов алюминия в самолетостроении:
А) хорошая электропроводность,
В) пластичность,
С) легкость и прочность в сплавах,
D) неядовитость.
2 вариант
1.Количество нейтронов в атоме алюминия:
А) 12,
В) 13,
С) 10,
D) 14.
2.Электронная формула атома алюминия:
А) 1s22s22p6.
B) 1s22s22p63s2.
C) 1s22s22p63s1.
D) 1s22s22p63s2p1.
3. Алюминий более активен, чем:
А) сера,
B) натрий,
С) калий,
D) кальций.
4. Вид химической связи у алюминия:
А) ионная,
В) металлическая,
С) ковалентная,
D) водородная.
5. На каком физическом свойстве алюминия основано применение алюминия в электротехнике:
А) хорошая электропроводность,
В) пластичность,
С) легкость и прочность в сплавах,
D) неядовитость.
Проверка теста (слайд 17).
4. К началу урока: эпиграфу, что изучили на уроке, что узнали нового.
- Итак, вернемся к началу урока и проверим, выполнили мы с вами поставленные задачи (обсуждение, выводы).
5. Задание на дом (слайд 18).
Раздать карточки с д/з. Инструктаж выполнения домашнего задания (дифференцированного).
6. Подведение итогов, оценка работы учащихся на уроке.
- Попробуем самостоятельно оценить свою работу на уроке.
- Для этого у вас в лотках есть смайлики, но вы заметили, что на них нет эмоций. Добавим их на смайлики: улыбку, если получили прочные знания, усвоили весь материал; сомнение, если усвоили материал частично; грусть, если мало что поняли, необходимо еще поработать. В конце урока положите их мне на стол.
Оценка работы учащихся на уроке, выставление отметок учащимся.
Поблагодарить учащихся за работу на уроке (последний слайд). (слайд 19).
Металл с серебристо-белым, мягким, немагнитным и пластичным металлическим свойством известен как алюминий.
Алюминиевый символ — «А1», а его атомный номер — «13» .
Химический элемент алюминий относится к группе бора.
Металлический алюминий является химически активным элементом.
Алюминий обладает потенциалом противостоять коррозии, и процесс этого удельного сопротивления известен как пассивация.
Алюминий — сравнительно прочный, легкий, мягкий, ковкий и пластичный металл.
Алюминий немагнитен и не легко воспламеняется.
Алюминиевая пленка является очень хорошим отражателем видимого света, поскольку она отражает более 90 процентов входящих лучей.
Алюминий обычно реагирует с водой и образует водород.
Алюминий является металлом низкой плотности и обладает свойством противостоять коррозии.
Алюминий обладает свойством теплопроводности и электропроводности и, следовательно, является хорошим проводником.
Алюминий составляет (около) 8 процентов земной коры.
После кислорода и кремния алюминий является третьим по распространенности элементом; однако, это самый распространенный металл в коре.
Когда водород плавится с магнием, он создает стабильный алюминий.
Алюминий естественным образом содержится в оксидах или силикатах.
Ниже приведены основные соединения алюминия —
Глинозем — Al 2 O 3
Алюминий хлорид — AlCl 3
Сульфат алюминия — Al 2 (SO 4 ) 3
Гидроксид алюминия — Al (OH) 3
Карбид алюминия — Al 4 C 3
Алюминий имеет широкий спектр применения в промышленности, а также в повседневной жизни; значительные из них —
Алюминий используется в таких отраслях транспорта, как железная дорога, автомобили, самолеты, космические корабли, грузовики, морские суда, велосипеды и т. Д.
Алюминий используется в упаковке некоторых специфических материалов.
Алюминий используется в конструкциях дверей, окон, строительной проволоки, обшивки, кровли и т. Д.
Алюминий в основном используется для изготовления электрических проводов.
Алюминий используется в производстве бытовой техники и многих других предметов домашнего обихода, таких как кухонная утварь.
Алюминий используется в бейсбольных битах, часах и многих других подобных материалах.
Алюминий используется в фототехнике.
Алюминий используется в электронных приборах.
В качестве отражателя света используется алюминий, так как он является хорошим отражателем света; в основном, некоторые материалы имеют алюминиевое покрытие, специально предназначенное для отражения света.
Алюминий используется в производстве газообразного водорода по реакции с соляной кислотой.
Алюминий используется в производстве музыкальных инструментов.
Кроссенс – это ассоциативная головоломка.
Название «кроссенс» переводится с английского языка как «пересечение смыслов»
и придумано по аналогии с словом «кроссворд», что означает «пересечение слов»…
Рассмотрите изображения. Как они связаны с темой этого урока?
Я начну с более сложных ассоциаций
1. Виктор Цой. В его репертуаре есть песня "Алюминиевые огурцы" 2.Обшивка космического челнока "Буран" была выполнена из сплава алюминия и скандия. 3. Экран смартфона. В его состав входит оксид алюминия, который по прочности уступает только алмазам. |
4. Наполеон III. 5. Рубиновые звёзды. 6. Хамелеон. 7. Пёрышко. 8. Audi 80
Кроссенс .Алюминий
1. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления.
Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная масса Ar(Al) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл.
Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
Al +13 )2)8)3 , p – элемент,
Алюминий проявляет в соединениях степень окисления +3:
Al0 – 3 e- → Al+3
2. Физические свойства
Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Температура плавления 650 оС. Алюминий имеет невысокую плотность (2,7 г/см3) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл.
3. Нахождение в природе
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
В природе алюминий встречается только в соединениях (минералах).
На сегодняшний день известно почти 300 различных соединений и минералов алюминия – от полевого шпата, являющегося основным породообразующим минералом на Земле, до рубина, сапфира или изумруда, уже не столь распространенных.
| Бокситы — Al2O3 • H2O (с примесями SiO2, Fe2O3, CaCO3) | Нефелины — KNa3[AlSiO4]4 | Алуниты — KAl(SO4)2 • 2Al(OH)3 | Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3) | Корунд — Al2O3 |
| Полевой шпат (ортоклаз) — K2O×Al2O3×6SiO2 | Каолинит — Al2O3×2SiO2 × 2H2O | Алунит — (Na,K)2SO4×Al2(SO4)3×4Al(OH)3 | Берилл — 3ВеО • Al2О3 • 6SiO2 | Рубин— Al2O3 |
Рубины, сапфиры, изумруды и аквамарин являются минералами алюминия.
Первые два относятся к корундам – это оксид алюминия (Al2O3) в кристаллической форме. Он обладает природной прозрачностью, а по прочности уступает только алмазам. Пуленепробиваемые стекла, иллюминаторы в самолетах, экраны смартфонов производятся именно с применением сапфира.
А один из менее ценных минералов корунда – наждак используется как абразивный материал, в том числе для создания наждачной бумаги.
4. Химические свойства алюминия и его соединений
Алюминий имеет редкое сочетание ценных свойств. Это один из самых легких металлов в природе: он почти в три раза легче железа, но при этом прочен, чрезвычайно пластичен и не подвержен коррозии, так как его поверхность всегда покрыта тончайшей, но очень прочной оксидной пленкой. Он не магнитится, отлично проводит электрический ток и образует сплавы практически со всеми металлами.
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид).
Алюминий |
ДЕМОНСТРАЦИЯ ОКСИДНОЙ ПЛЁНКИ
Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия со ртутью – амальгамы).
I. Взаимодействие с простыми веществами
Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С), с йодом в присутствии катализатора - воды:
2Аl + 3S = Аl2S3 (сульфид алюминия),
2Аl + N2 = 2АlN (нитрид алюминия),
Аl + Р = АlР (фосфид алюминия),
4Аl + 3С = Аl4С3 (карбид алюминия).
2 Аl + 3 I2 = 2 AlI3 (йодид алюминия)
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
4Аl + 3O2 = 2Аl2О3 + 1676 кДж.
ГОРЕНИЕ АЛЮМИНИЯ НА ВОЗДУХЕ
Если Вы хорошо изучили эту часть урока,ответьте на 5 вопросов теста
II. Взаимодействие со сложными веществами
Взаимодействие с водой:
2 Al + 6 H2O = 2 Al (OH)3 + 3 H2
без оксидной пленки
Взаимодействие с оксидами металлов:
Алюминий – хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов. Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др.
3 Fe3O4 + 8 Al = 4 Al2O3 + 9 Fe +Q
Термитная смесь Fe3O4 и Al (порошок) –используется ещё и в термитной сварке.
Сr2О3 + 2Аl = 2Сr + Аl2О3
Взаимодействие с кислотами:
С раствором серной кислоты: 2 Al + 3 H2SO4 = Al2(SO4)3 + 3 H2
С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
2Аl + 6Н2SО4(конц) = Аl2(SО4)3 + 3SО2 + 6Н2О,
Аl + 6НNO3(конц) = Аl(NO3)3 + 3NO2 + 3Н2О.
Взаимодействие со щелочами.
2 Al + 2 NaOH + 6 H2O = 2 Na[Al(OH)4] + 3 H2
Na[Аl(ОН)4] – тетрагидроксоалюминат натрия
По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов.
С растворами солей:
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
Обнаружение ионов алюминия в растворах:
Если поверхность алюминия потереть солью ртути, то происходит реакция:
2Al + 3HgCl2 = 2AlCl3 + 3Hg
Выделившаяся ртуть растворяет алюминий, образуя амальгаму.
5. Применение алюминия и его соединений
РИСУНОК 1 РИСУНОК 2
6. Получение алюминия
1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na3AlF6 растворяет Al2O3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия - электролитом.
2Al2O3 эл.ток→ 4Al + 3O2
ЭТО ИНТЕРЕСНО:

Если Вы хорошо изучили эту часть урока,ответьте на 10 вопросов теста
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
ТРЕНАЖЁРЫ
Тренажёр №1 - Характеристика алюминия по положению в Периодической системе элементов Д. И. Менделеева
Тренажёр №2 - Уравнения реакций алюминия с простыми и сложными веществами
Тренажёр №3 - Химические свойства алюминия
Этот металл известен уже более 2000 лет и характеризуется широким техническим применением. Итак, для чего мы можем его использовать?
В алюминиевой промышленности, также известный под другим названием - алюминий, в основном используется в виде сплавов с другими элементами, что улучшает его эксплуатационные свойства.В таком виде это универсальный строительный материал с очень универсальным применением. Среди алюминиевых сплавов можно выделить, среди прочего, литейные сплавы и сплавы, применяемые для обработки пластмасс. Помимо алюминия, в их состав входят такие элементы, как медь, магний, кремний и марганец. Алюминиевые сплавы используются, в частности, в авиационной, химической, автомобильной и даже судостроительной промышленности.
Алюминийтакже широко используется в промышленности в чистом виде.В этой форме он используется для производства различных предметов повседневного обихода, таких как, например, зеркала, банки для напитков и продуктов питания, кухонная утварь или широко известная алюминиевая фольга. Он также используется в производстве химического оборудования, электрических кабелей и даже взрывчатых веществ. Для выделения этого элемента из бокситовой руды необходимо провести два последовательных этапа. Первый — это процесс Байера, который позволяет получить оксид алюминия из минерала. Затем соединение подвергают электролизу с получением алюминия технической чистоты.
Чистый алюминий не встречается в природе из-за его способности к пассивации. Это явление представляет собой окисление металла в присутствии воздуха, в результате чего на его поверхности образуется пассивный защитный слой. В случае с алюминием его сначала покрывают слоем оксида алюминия (Al 2 O 3 ) толщиной несколько нм. Затем под воздействием влаги наружный слой частично гидролизуется, что дополнительно дает гидроксид, т.е. Al(OH) 3 .
Алюминий является компонентом различных природных минеральных пород в виде руд. Бокситовые глинистые руды в основном используются для производства чистого алюминия. Они образуются в основном в местах выветривания алюмосиликатных пород в условиях жаркого климата и также содержат соединения железа. Это породы характерного красного или коричневого цвета, которые бывают двух типов: силикатные и карбонатные.
Глина технической чистоты (более 99%) производится в промышленных масштабах двумя последовательными способами.На первом этапе получают оксид алюминия (процесс Байера), а на следующем этапе проводят процесс электролитического восстановления (электролиз Холла-Эру), благодаря которому получают чистый алюминий. Из-за снижения затрат, связанных с транспортировкой бокситовой руды, большинство обогатительных фабрик строятся вблизи рудников.
Первым этапом после добычи руды является промывка водой. Таким образом удаляется большая часть растворимых в нем загрязнений.Затем к приготовленному таким образом сырью добавляют СаО, т.е. оксид кальция. Все это измельчается специальными трубчатыми мельницами до получения зерен очень малого диаметра, то есть менее 300 мкм. Тонкий помол сырья чрезвычайно важен, так как обеспечивает достаточно большую удельную поверхность зерен, что, в свою очередь, приводит к более эффективному процессу экстракции.
Следующим этапом производства глинозема является растворение зерен водным раствором едкого натра.В Группе РСС гидроксид натрия производится методом мембранного электролиза. Полученный таким образом продукт характеризуется чрезвычайно высоким качеством и чистотой, отвечающими требованиям последней редакции Европейской фармакопеи. Смесь, содержащая молотые зерна и едкий натр, хранится в течение нескольких часов в специальных реакторах, называемых автоклавами. В процессе осаждения в реакторах поддерживаются высокое давление и повышенная температура. Таким образом получают алюминат натрия, который затем очищают с помощью различных фильтров.
На следующем этапе происходит разложение очищенного раствора алюмината натрия. В результате получают гидроксид натрия (он же водный раствор едкого натра) и кристаллы гидроксида алюминия высокой чистоты. Осадок, полученный при кристаллизации, отфильтровывают и промывают водой. В свою очередь, оставшийся гидроксид натрия нагревается и рециркулируется для повторного использования в процессе.
Завершающим этапом производства глинозема является прокаливание. Он заключается в нагревании гидроксида алюминия при температуре выше 1000 на С, в результате чего происходит его разложение до Al 2 O 3 , который получается в виде чисто белого порошка.Подготовленный таким образом глинозем транспортируют в печи для получения металлического алюминия в процессе электролитического восстановления.
Следующим этапом получения чистого алюминия является проведение процесса электролиза по методу Холла-Эру. Сначала полученный в процессе Bayer Al 2 O 3 расплавляют с криолитом и приготовленный таким образом раствор подвергают процессу электролиза при температуре не выше 900 o С.Полученный таким образом жидкий алюминий отделяют от электролита и удаляют из электролитных ванн с помощью так называемого вакуумные сифоны. Затем сырье поступает на литейное оборудование, откуда подается в обогреваемые печи, где происходит процесс рафинирования. Он заключается в очистке алюминия с целью получения максимально возможной его чистоты. Техническую глину можно очищать двумя способами. Первый включает плавление алюминия и пропускание через него хлора, в результате чего загрязняющие вещества связываются в виде хлорида и удаляются из процесса.Второй способ – электролитическое восстановление сплава алюминия с медью. Конечный продукт, полученный таким образом, характеризуется очень высокой чистотой.
Разработка метода производства чистого алюминия из бокситов с использованием процесса Байера и электролиза Холла-Эру расширила применение этого элемента новыми возможностями. Кроме того, сочетание высокой прочности и легкости означает, что в некоторых случаях он может заменить сталь, которая дешевле.Устойчивость к погодным условиям позволяет использовать алюминий в производстве профилей для окон и дверей. Еще одним преимуществом является возможность многократной переработки, что делает его относительно экологически чистым материалом.
Таким образом, алюминий является чрезвычайно универсальным материалом, который широко используется в пищевой, энергетической, химической, транспортной, строительной, автомобильной и аэрокосмической промышленности. Благодаря своим многочисленным преимуществам, это, вероятно, не конец его использования, и он продолжит набирать популярность в ближайшем будущем.
.Знаете ли вы, что алюминий впервые был получен в 1825 году датским физиком Гансом Христианом Эрштедтом? Однако его метод извлечения был трудоемким и дорогим, и только через 61 год Поль Луи-Туссен Эру и Шарль Мартин Холл разработали метод, позволяющий производить этот металл в промышленных масштабах.
Сегодня мы используем алюминий в строительстве, на транспорте, в электроэнергетике, а также в бытовых товарах, как и всем известная алюминиевая фольга.Он легкий, устойчивый к коррозии, прочный и очень пластичный, что позволяет ему свободно формироваться. Однако, чтобы очистить его, мы должны использовать соответствующую химию для алюминия.
 Чтобы алюминий оставался блестящим и гладким, необходимо использовать травители. Alu Clean – средство для погружения в ванну. Он протравливает целые поверхности и за несколько мгновений эффективно обеспечивает блестящую и чистую поверхность без обесцвечивания.Продукт характеризуется высокой эффективностью. С другой стороны, травильная паста Gel Al идеально подходит для локального травления сварочных швов и удаления образовавшейся окалины.
Чтобы алюминий оставался блестящим и гладким, необходимо использовать травители. Alu Clean – средство для погружения в ванну. Он протравливает целые поверхности и за несколько мгновений эффективно обеспечивает блестящую и чистую поверхность без обесцвечивания.Продукт характеризуется высокой эффективностью. С другой стороны, травильная паста Gel Al идеально подходит для локального травления сварочных швов и удаления образовавшейся окалины.
Средство гарантирует тщательное удаление пятен, возникших после сварки или сварки. Большим преимуществом алюминия является то, что он может быть переработан на 100%. Поэтому, если вы хотите очистить ранее окрашенную поверхность, мы рекомендуем Paint and Coating Remover Aviator , это иммерсионная ванна, позволяющая полностью удалить краску с металлов.Предназначен как для промышленного использования, так и для небольших любительских работ. Агент работает при температуре окружающей среды или нагревается. Идеально подходит для использования в малярных мастерских, а также для исправления жестянщиками.

Перед покраской металл необходимо тщательно обезжирить. Для этого отлично подойдет моющий и обезжиривающий препарат для алюминия Lubent Al. Благодаря своему составу справится даже с сильными промышленными загрязнениями.Средство имеет низкое пенообразование, что позволяет быстро и легко смывать его. Он подходит для использования на последующих этапах производства, а также для очистки готового продукта.
Несмотря на то, что алюминий обладает высокой антикоррозионной стойкостью, стоит защитить изделия специальным фосфатирующим концентратом Condorfos - , предназначенным для стальных, оцинкованных и алюминиевых поверхностей. Идеально подходит перед лакировкой - обезжиривает и фосфатирует стекло, что делает его отличной основой для следующих этапов работы.
Средство содержит ингибиторы коррозии. Если вы хотите защитить сталь, металл и их сплавы от коррозии, используйте алюминиевый спрей , простота нанесения позволит создать быстросохнущий защитный слой. Препарат характеризуется высокой устойчивостью к экстремальным температурам и неблагоприятным погодным условиям. Рекомендуется для автомобильной, строительной, отопительной и климатической промышленности, а также для декоративно-отделочных работ.
Несмотря на то, что это один из самых прочных продуктов среди металлов, даже алюминий нуждается в надлежащем уходе и чистке.Только выбирая специализированные качественные препараты, вы гарантируете, что ваша продукция будет радовать ваших клиентов долгие годы.
.Зум
Фотографии защищены авторским правом.Копирование их без согласия сайта запрещено.
Особенности продукта| Производитель | CLINEX |
| INDEX | |
| Использование | Алюминий; алюминиевые детали; Алюминиевые колеса |
| 5 | 5 |
Нет отзывов о товаре
PLN 68.45 Цена за 1 штуку
80,53 зл. Вы экономите € 12,08
Курьерская доставка DHL 12,30 злотых 1-2 рабочих дня
Доставка курьером DPD. 11,30 злотых 1-3 рабочих дня
| Производитель | CLINEX |
| Индекс | ALUM 5L |
| алюминий; алюминиевые детали; алюминиевые колеса | |
| Вместимость [л] | 5 |
| Упаковка | Пластиковый контейнер |
Мы хотим, чтобы вам было удобно пользоваться нашим сайтом.Для этого мы стараемся адаптировать контент, доступный на нашем веб-сайте, к вашим предпочтениям. Это возможно благодаря хранению файлов cookie в вашем браузере и их обработке компанией Inter Cars S.A., расположенной в Варшаве, ул. Powsińska 64, 02-903 Warszawa и персональные данные доверенных партнеров для аналитических, статистических и маркетинговых целей. Продолжая использовать наш веб-сайт без изменения настроек конфиденциальности, вы даете согласие на сохранение файлов cookie в вашем браузере.Помните, что вы всегда можете изменить настройки файлов cookie, получить дополнительную информацию о правилах обработки ваших персональных данных и ваших правах в нашей Политике конфиденциальности.
× .Настройки файлов cookie
Здесь вы можете определить свои предпочтения в отношении использования нами файлов cookie.Требуется для работы страницы
Эти файлы cookie необходимы для работы нашего веб-сайта, поэтому вы не можете их отключить.
Функциональный
Эти файлы позволяют использовать другие функции сайта (кроме необходимых для его работы).Включив их, вы получите доступ ко всем функциям веб-сайта.
Аналитический
Эти файлы позволяют нам анализировать наш интернет-магазин, что может способствовать его лучшему функционированию и адаптации к потребностям Пользователей.
Поставщики аналитического программного обеспечения
Эти файлы используются поставщиком программного обеспечения, под которым работает наш магазин.Они не объединяются с другими данными, введенными вами в магазине. Целью сбора этих файлов является выполнение анализа, который будет способствовать разработке программного обеспечения. Вы можете прочитать больше об этом в политике использования файлов cookie Shoper.
Маркетинг
Благодаря этим файлам мы можем проводить маркетинговые мероприятия.
.
То же самое или не то же самое? Можно ли использовать эти слова взаимозаменяемо? Хотя в английском, испанском, немецком и, вероятно, в подавляющем числе языков мира оба польских термина имеют один и тот же эквивалент, в польском языке разница может быть незначительной, но существенной. Короче, химиков и физиков заинтересуют менты, алюминиевые техники и инженеры.
Алюминий, являющийся элементом
Алюминий — это название химического элемента в таблице Менделеева, расположенного под бором (а так как он трехвалентен) и между магнием и кремнием. От латинского названия элемента - алюминий (не очень удивительно, не так ли?) происходит химический символ алюминия - Al.
Наряду с кремнием является наиболее распространенным элементом в земной коре, хотя он высокодисперсен и встречается в виде различных химических соединений, в основном алюмосиликатов.Алюминий при комнатной температуре представляет собой мягкое металлическое твердое вещество серебристого цвета, обладающее тремя характеристиками, которые делают его чрезвычайно интересным. Во-первых, он обладает амфотерными свойствами.
Это сложное слово просто означает, что он может действовать как кислота и основание в химических реакциях. Следовательно, он может образовывать положительно заряженные катионы или отрицательно заряженные анионы (в этом случае обычно в сопровождении кислорода). Амфотерными являются только небольшой процент элементов, из которых наиболее распространен алюминий.Еще одной особенностью является его легкость, ведь алюминий в два с половиной раза легче железа и один литр (дм 3 ) алюминия весит 2,7 кг.
В-третьих, алюминий реагирует с кислородом воздуха, но только на поверхности (так называемая пассивация). Полученный слой оксида алюминия является воздухонепроницаемым и защищает внутреннюю часть от дальнейшего окисления, как, к сожалению, в случае с изделиями из железа, где ржавчина отслаивается и отслаивается, обнажая последовательные слои материала, которые начинают ржаветь дальше.
Боровская модель атома алюминияАлюминий или сплав
Хорошо, а алюминий?
Это строительный материал, представляющий собой алюминий технической чистоты, т.е. содержащий не менее 1% примесей других элементов, в основном металлов, таких как, например, магний. Таким образом, алюминий представляет собой алюминиевый сплав, а не сам химически чистый алюминий.
Эта небольшая добавка (хотя иногда и достигающая десятка процентов) позволяет значительно улучшить механические свойства, сохранив при этом две особенности, за которые конструкторы любят алюминий, а именно легкость и устойчивость к воздуху. Одним из самых популярных сплавов является так называемый дюралюминий (дюралюминий), в котором алюминий сплавляется с магнием, марганцем и медью. Существует две теории происхождения названия: первая связывает приставку с латинским словом durus (что означает «твердый»), а вторая — с немецким городом Дюрен, где был разработан этот сплав.
Я еще не упомянул об одной особенности алюминиевых сплавов. Они неплохо проводят электричество, хотя и не являются рекордсменами в этом отношении (здесь на подиуме серебро, медь и золото соответственно), но соотношение проводимости к цене и весу кабеля означало, что, наверное, половина Польши имеет алюминиевая инсталляция в стенах на данный момент эл. В этом отношении, однако, следует признать, что современная тенденция замены алюминиевых проводников медными оправдана. Проводимость меди выше, что снижает потери, кроме того, медь более ковкая и гибкая.Хрупкие и ломкие алюминиевые провода свели с ума многих электриков (в том числе даже доморощенных вроде меня) и у них на совести множество коротких замыканий и, соответственно, пожаров.
Производство алюминия
Список стран, являющихся крупнейшими производителями алюминия, содержит некоторые сюрпризы. Китай, Россия или США никого не удивят. Чуть больше несколько ближневосточных стран с ОАЭ или Норвегией.Но, пожалуй, больше всего удивляет маленькая Исландия, производство которой почти такое же, как в США!
Важно отметить, что ни в арабских странах, ни в Исландии и Норвегии нет месторождений бокситов, которые являются основным сырьем для производства алюминия. Бокситы добываются в основном в Южной Америке, Карибском бассейне и Австралии. Таким образом, в случае с Исландией сырье доставляется на этот субарктический остров, обрабатывается там на алюминиевых заводах и загружается обратно на корабли, которые доставляют алюминиевые слитки на заводы в Европе и Северной Америке.И где во всем этом логика?
Как говорится, если ты не знаешь, что происходит, значит, дело в деньгах.
Здесь тоже так. Во-первых, давайте кратко обсудим процесс производства алюминия. Во-первых, бокситы, состоящие в основном из различных видов гидроксида алюминия, сплавляют с гидроксидом натрия (так называемой каустической содой).
Это позволяет легче отделить соединения алюминия от других веществ, содержащихся в боксите. Полученный концентрат смешивают с другим фторсодержащим соединением лития, т.е. криолитом, и расплавляют при температуре ок.1000°С. И вот тут-то и начинается самое интересное, ведь к такой расплавленной смеси подключается электрический ток, который вызывает выделение чистого алюминия (так называемый электролиз расплавленной соли алюминия).
Это очень упрощенное описание, но самое главное помнить, что производство алюминия очень энергоемко, потому что для нагрева сплава и его электролиза используется огромное количество электроэнергии. Так что окупается возить сырье туда, где энергия дешевая, т.е. на Ближний Восток (нефть известна) и на крайний север в Норвегию или Исландию, которые имеют огромные излишки энергии от гидроэлектростанций, а в случае Исландии также геотермальные.О, и весь секрет.
 Боксит из Pala del Coll de Porta (Испания)
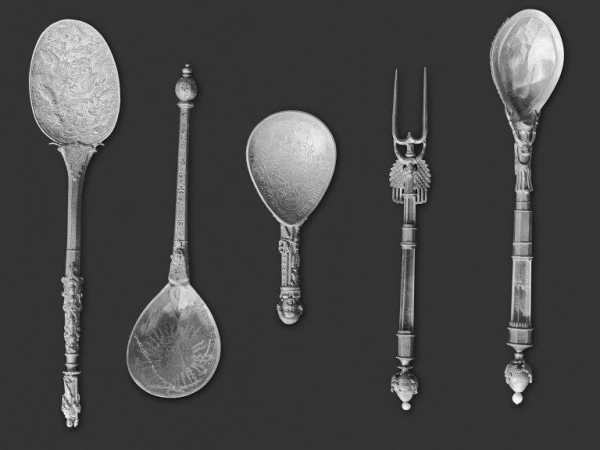
Боксит из Pala del Coll de Porta (Испания) Я хотел бы Добавим, что до того, как в конце XIX века стал популярен вышеупомянутый процесс (названный по именам его создателей процессом Холла-Эру), производство алюминия стоило во много раз дороже, чем сегодня, а значит, было довольно используется время от времени, например, для производства роскошных столовых приборов.Хотя мы можем этого не осознавать, мы многим обязаны ученым и инженерам, разработавшим производство алюминия. Ведь его дешевое производство произвело революцию в нашем мире. Без него было бы невозможно развитие авиационной и космической техники.
Алюминиевые конструкционные элементы есть в наших домах и автомобилях. Некоторым людям нравятся их сверхлегкие велосипеды, которые они могут поднять одним пальцем. И хотя в 21 веке алюминий в этих приложениях иногда заменяют пластиковыми композитами, давайте признаемся - кто из нас никогда не использовал на кухне алюминиевую фольгу или алюминиевые противни-гриль, кто?
Войцех Смулек
.